प्रतिपिंड

प्रतिपिंड (एंटीबॉडी), (इम्युनोग्लोबुलिन(immunoglobulins), संक्षिप्ताक्षर में आईजी (Ig)) के नाम से भी जाने जाते हैं, गामा रक्तगोलिका (globulin) प्रोटीन हैं, जो मेरुदण्डीय प्राणियों के रक्त या अन्य शारीरिक तरल पदार्थों में पाए जाते हैं, तथा इनका प्रयोग प्रतिरक्षा प्रणाली द्वारा बैक्टीरिया तथा वायरस (विषाणु) जैसे बाह्य पदार्थों को पहचानने तथा उन्हें बेअसर करने में किया जाता है। ये आम तौर पर पांच संरचनात्मक ईकाइयों से मिल कर बने हैं-जिनमे से प्रत्येक की दो बड़ी व भारी श्रृंखलाएं तथा दो छोटी व हल्की श्रृंखलाएं होती हैं-जो एक साथ मिल कर, उदाहरण के लिए, एक इकाई के साथ मोनोमर्स (monomers), दो इकाईयों के साथ डाइमर्स (dimers) और पांच इकाईयों के साथ मिल कर पेंटामर्स (pentamers) बनाती हैं। प्रतिपिंड (एंटीबॉडी) एक प्रकार की सफ़ेद रक्त कोशिका से निर्मित होते हैं जिन्हें प्लाविका कोशिका (प्लाज़्मा सेल) कहा जाता है। प्रतिपिंड (एंटीबॉडी) भारी श्रृंखलाएं तथा प्रतिपिंड (एंटीबॉडी) भी कई विभिन्न प्रकार के हैं, जो सामूहिक रूप से अलग-अलग प्रकार के आइसोटाइप (isotypes) बनाते हैं, जो उनकी भारी श्रृंखला पर आधारित होते हैं। स्तनधारियों में पांच विभिन्न प्रकार के प्रतिपिंड (एंटीबॉडी) ज्ञात हैं, जो अलग अलग कार्य करते हैं, तथा वे विभिन्न प्रकार के बाह्य पदार्थ से लड़ने के लिए उचित प्रतिरक्षा (इम्यून) प्रतिक्रिया को जानने में सहायता करते हैं।
हालांकि सभी प्रतिपिंडों (एंटीबॉडी) की सामान्य संरचना बहुत समान होती है, प्रोटीन की नोक पर छोटा सा क्षेत्र अत्यंत परिवर्तनशील है, जो थोड़ी अलग टिप संरचनाओं वाले लाखों प्रतिपिंडों (एंटीबॉडी) या प्रतिजन (एंटीजन) को अस्तित्व में बने रहने की अनुमति देता है। इस क्षेत्र को अत्याधिक परिवर्तनशील (hypervariable) क्षेत्र के रूप में जाना जाता है। इनमें से प्रत्येक प्रकार (वेरिएंट) अन्य लक्ष्य के साथ जुड़ सकता है जिसे प्रतिजन (एंटीजन) कहते हैं। प्रतिपिंडों (एंटीबॉडी) में यह विशाल विविधता प्रतिरक्षा प्रणाली को समान रूप से विशाल विविधता वाले प्रतिजनों (एंटीजन) के प्रकारों को पहचानने में सहायता करती है। प्रतिपिंड (एंटीबॉडी) द्वारा पहचाना गया प्रतिजन (एंटीजन) का विशिष्ट भाग एपिटोप (epitope) कहलाता है। ये एपीटोप अपने प्रतिपिंड (एंटीबॉडी) के साथ अत्याधिक विशिष्ट प्रक्रिया द्वारा जुड़ जाते हैं, जिसे इंड्यूस्ड फिट (induced fit) कहते हैं, तथा जो शरीर की रचना के लिए जिम्मेवार लाखों विभिन्न अणुओं के बीच प्रतिपिंड (एंटीबॉडी) को केवल अपने विशिष्ट प्रतिजन (एंटीजन) को पहचानने तथा उसके साथ जुड़ने की अनुमति देते हैं। प्रतिपिंड (एंटीबॉडी) द्वारा एक प्रतिजन (एंटीजन) की पहचान इसे प्रतिरक्षा (प्रतिरक्षा (immune)) प्रणाली के अन्य भागों द्वारा हमले के लिए चिह्नित करती है। प्रतिपिंड (एंटीबॉडी) लक्ष्यों को सीधे भी बेअसर कर सकते हैं, उदाहरण के लिए, रोगज़नक़ (pathogen) के हिस्से के साथ जुड़ कर, जो संक्रमण का कारण बन सकता है।
प्रतिपिंड (एंटीबॉडी) की बड़ी और विविध जनसंख्या जीन खण्डों के क्रमरहित संयोजनों से बनती है जो विभिन्न प्रतिजन (एंटीजन) को जोड़ने वाली साइटों (या पैराटोप (paratopes)) को कूटबद्ध करती है, जिसके बाद प्रतिपिंड (एंटीबॉडी) जीन के इस क्षेत्र में क्रमरहित स्थिति परिवर्तन (mutations) होते हैं, जो विविधता को और अधिक बढ़ाते हैं। प्रतिपिंड (एंटीबॉडी) जीन भी वर्ग परिवर्तन (class switching) प्रक्रिया द्वारा खुद को फिर से संगठित कर के भारी श्रृंखला के आधार को दूसरे में परिवर्तित कर के, प्रतिपिंड (एंटीबॉडी) का अलग प्रकार का आइसोटाइप बनाते हैं जो प्रतिजन (एंटीजन) विशेष के बदलाव क्षेत्र को बनाए रखता है। यह एकल प्रतिपिंड (एंटीबॉडी) को प्रतिरक्षा (immune) प्रणाली के कई अलग अलग भागों द्वारा इस्तेमाल किये जाने की अनुमति देता है। प्रतिपिंडों (एंटीबॉडी) का उत्पादन शारीरिक प्रतिरक्षा प्रणाली का मुख्य कार्य है।
अनुक्रम
प्रकार
सरफेस इम्युनोग्लोबुलिन (आईजी/Ig) अपने ट्रांसमेम्बरेन क्षेत्र द्वारा प्रभाव डालने वाली बी कोशिकाओं (B cells) की झिल्ली (मेम्बरेन) से जुड़ा है, जबकि प्रतिपिंड (एंटीबॉडी) आईजी/Ig का स्रावी प्रकार है और इसमें ट्रांस मेम्बरेन क्षेत्र की कमी होती है, इसलिए प्रतिपिंड (एंटीबॉडी) रक्तधारा और शरीर के मुलायम हिस्सों में स्रावित किए जा सकते हैं। परिणामस्वरूप, ट्रांस मेम्बरेन क्षेत्रों के अलावा, सरफेस आईजी/Ig और प्रतिपिंड (एंटीबॉडी) समान हैं। इसलिए, वे प्रतिपिंड (एंटीबॉडी) के दो प्रकारों के रूप में जाने जाते हैं: घुलनशील प्रकार या मेम्बरेन बाउंड प्रकार (परहम/Parham 21-22).
एक प्रतिपिंड (एंटीबॉडी) के मेम्बरेन बाउंड प्रकार को ़आक्क्॓ःण्ःझ्क्कीब्ब्ण्क्ष्ड्क्क्/फ़्ब्ब्ग्गीळ्२झ्ःफ़ृ२ओळू३ञृ ब्ब्सरफेस इम्युनोग्लोबुलिन (एसआईजी/sIg) या मेम्बरेन इम्युनोग्लोबुलिन (एमआईजी/mIg) कहा जा सकता है। यह बी (B) कोशिका रिसेप्टर (बीसीआर (BCR)) का एक भाग है, जो बी कोशिका (B Cell) को शरीर में विशिष्ट प्रतिजन (एंटीजन) का पता लगाने की अनुमति देता है और बी कोशिका (B Cell) सक्रियण शुरू करता है। बीसीआर (BCR) सरफेस-बाउंड आईजीडी (IgD) या आईजीएम (IgM) से मिल कर बना होता है और इसमें Ig-α और Ig-β हीट्रोडाइमर (heterodimers) जुड़े होते हैं, जो संकेत हस्तांतरित करने में सक्षम हैं। एक सामान्य मानव बी कोशिका (B Cell) की सतह से 50000 से 100000 प्रतिपिंड (एंटीबॉडी) जुड़े होते हैं। प्रतिजन (एंटीजन) से जुड़ने के पश्चात्, वे लिपिड राफ्ट्स पर बड़े धब्बों, जो व्यास में 1 माइक्रोमीटर से अधिक बढ़ सकते हैं, के रूप में दिखाई देते हैं, जो बीसीआर (BCR) को रिसेप्टर का संकेत देने वाली दूसरी कोशिका से अलग करते हैं। ये धब्बे सेल्युलर प्रतिरक्षा प्रतिक्रिया की दक्षता में सुधार कर सकते हैं। मनुष्यों में, बी कोशिका (B Cell) रिसेप्टर के चारों ओर कई हज़ार एंगस्टोर्म्स (ångstroms) के लिए कोशिका सतह नंगी होती है, जो आगे चल कर बीसीआर (BCR) को प्रतिस्पर्धी प्रभावों से अलग करती है।
आइसोटाइप
प्रतिपिंड (एंटीबॉडी) विभिन्न प्रकारों में उपलब्ध हैं जिन्हें आइसोटाइप या वर्ग (classes) कहा जाता है। स्तनधारी भ्रूणों में पांच तरह के प्रतिपिंड (एंटीबॉडी) आइसोटाइप पाए जाते हैं जिन्हें आईजीए (IgA), आईजीडी (IgD), आईजीई (IgE), आईजीजी (IgG) और आईजीएम (IgM) कहते हैं। इन सबका नाम आईजी/Ig उपसर्ग से शुरू होता है जिसका अर्थ है इम्युनोग्लोबुलिन (immunoglobulin), जो प्रतिपिंड (एंटीबॉडी) का ही एक अन्य नाम है और इनके जैविक गुणों, कार्यात्मक स्थानों, तथा अलग अलग प्रतिजनों (एंटीजन) से निपटने की क्षमता में विभिन्नता पाई जाती है, जैसा कि उपरोक्त सारिणी में दर्शाया गया है।
कोशिका के विकास और सक्रियण के दौरान बी कोशिका (B Cell) के प्रतिपिंड (एंटीबॉडी) आईसोटाइप परिवर्तित होते हैं। अपरिपक्व बी कोशिकाएं (B cells) (B cells), जो कभी भी एक प्रतिजन (एंटीजन) के संपर्क में नहीं आईं, सीधी सादी बी कोशिकाओं (B cells) (B cells) के रूप में जानी जाती है तथा सेल सरफेस बाउंड फॉर्म (cell surface bound form) में केवल आइजीएम (IgM) आईसोटाइप को ही व्यक्त करती हैं। परिपक्वता की स्थिति तक पहुंचने पर बी कोशिकाएं (B cells) (B cells) आईजीएम (IgM) व आईजीडी (IgD), दोनों को व्यक्त करने लगती हैं-इन दोनों इम्युनोग्लोबुलिन (immunoglobulin) आइसोटाइपों की सह-अभिव्यक्ति बी कोशिका (B Cell) को 'परिपक्व' तथा प्रतिजन (एंटीजन) के लिए प्रतिक्रिया करने के लिए तैयार करती है। बी कोशिका (B cell) सक्रियण के पश्चात् एक प्रतिजन (एंटीजन) के साथ कोशिका से जुड़े प्रतिपिंड (एंटीबॉडी) के अणु के जुड़ने की प्रक्रिया होती है, जिसके कारण कोशिका विभाजित हो जाती है और एक प्रतिपिंड (एंटीबॉडी) बनाने वाली कोशिका में परिवर्तित हो जाती है जिसे प्लाविका कोशिका कहते हैं। इस सक्रिय अवस्था में बी कोशिका (B Cell), मेम्बरेन बाउंड फॉर्म (झिल्लीनुमा प्रकार) की बजाए स्राव के रूप में प्रतिपिंड (एंटीबॉडी) उत्पन्न करने लगती है। सक्रिय बी कोशिकाओं (B cells) की कुछ संतान कोशिकाएं आइसोटाइप परिवर्तन की प्रक्रिया से गुज़रती हैं, एक ऐसा तंत्र जो एंटीबॉडी के आईजीएम (IgM) या आईजीडी (IgD) को दूसरे एंटोबॉडी आइसोटाइप आईजीई/IgE, आईजीए/IgA या आइजीजी/IgG में बदल देता है, जिनकी प्रतिरक्षा प्रणाली में निर्धारित भूमिकाएं होती हैं।
संरचना
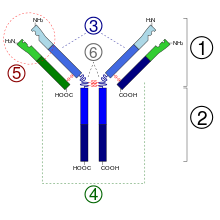
प्रतिपिंड (एंटीबॉडी) भारी (~150 केडीए/kDa) गोल आकार के प्लाविका प्रोटीन हैं। उनके कुछ अमीनो अम्ल अवशेषों के साथ चीनी की श्रृंखलाएं जुड़ी हैं। दूसरे शब्दों में, प्रतिपिंड (एंटीबॉडी) ग्लाइकोप्रोटीन (glycoprotein) हैं। प्रत्येक प्रतिपिंड (एंटीबॉडी) की मूल कार्यात्मक इकाई एक इम्यूनोग्लोबुलिन (आईजी/Ig) मोनोमर (जिसमे केवल एक आईजी/Ig इकाई शामिल है) होती है; स्रावित एंटीबॉडी आईजीए/IgA की तरह दो आईजी/Ig इकाइयों के साथ डाईमरिक (dimeric), टेलीओस्ट मछली के आईजीएम (IgM) की तरह चार आईजी/Ig इकाइयों के साथ टेट्रामेरिक (tetrameric) या स्तनधारी के आईजीएम (IgM) की तरह पांच आईजी/Ig इकाइयों के साथ पेंटामेरिक (pentameric) हो सकते हैं। प्रतिपिंड (एंटीबॉडी) के अस्थिर हिस्से इसके वी/V क्षेत्र और स्थिर हिस्से सी/C क्षेत्र हैं।
इम्युनोग्लोबुलिन प्रभाव-क्षेत्र
आईजी/Ig मोनोमर (monomer) एक "Y" के आकार का अणु होता है जो चार पॉलीपेप्टाइड श्रृंखलाओं से मिल कर बनता है, दो समान भारी श्रृंखलाएं और दो समान हल्की श्रृंखलाएं डाईसल्फाइड बन्धनों द्वारा जुड़ती हैं। प्रत्येक श्रृंखला संरचनात्मक प्रभाव-क्षेत्र से मिल कर बनती है जिन्हें इम्युनोग्लोबुलिन प्रभाव क्षेत्र कहा जाता है। इन प्रभाव क्षेत्रों में 70-110 अमीनो अम्ल होता है तथा इनके आकार व कार्यों के अनुसार इन्हें विभिन्न श्रेणियों (उदाहरण के लिए अस्थिर या आइजीवी/IgV और स्थिर या आईजीसी/IgC) में वर्गीकृत किया गया है। इनमें एक विशिष्ट इम्युनोग्लोबुलिन तह होती है, जिसमें दो बीटा शीट "सैंडविच" का आकार बनाती हैं तथा जो संरक्षित सिस्टीन (cysteines) तथा दूसरे आवेशित अमीनों अम्लों की परस्पर प्रक्रियाओं द्वारा जुड़ी रहती हैं।
भारी श्रृंखला
- इस विषय पर अधिक जानकारी हेतु, इम्यूनोग्लोबुलिन की भारी श्रृंखला पर जाएँ
स्तनधारियों में पांच तरह की आईजी/Ig भारी श्रृंखलाएं पाई जाती हैं जिन्हें यूनानी भाषा के अक्षरों: α, δ, ε, γ और μ द्वारा दर्शाया जाता है। दर्शायी गयी भारी श्रृंखला का प्रकार प्रतिपिंड (एंटीबॉडी) के वर्ग को परिभाषित करता है; ये श्रृंखलाएं क्रमशः आईजीए (IgA), आईजीडी (IgD), आइजीई (IgE), आइजीजी (IgG), व आईजीएम (IgM) में पाई जाती हैं। विशिष्ट भारी श्रृंखलाएं आकार तथा संरचना में भिन्न होती हैं; α और γ में लगभग 450 अमीनो अम्ल होते हैं, जबकि μ और ε में लगभग 550 अमीनो अम्ल होते हैं।
प्रत्येक भारी श्रृंखला के दो क्षेत्र होते हैं - स्थिर क्षेत्र और अस्थिर क्षेत्र . स्थिर क्षेत्र समान आइसोटाइप के सभी प्रतिपिंडों (एंटीबॉडी) में एक जैसा होता है, लेकिन विभिन्न प्रकार के आइसोटाइप के प्रतिपिंडों (एंटीबॉडी) में अलग होता है। भारी श्रृंखलाओं γ, α और δ का स्थिर क्षेत्र तीन अग्रानुक्रमों (एक रेखा में) आईजी/Ig प्रभाव क्षेत्र से बना होता है, तथा अतिरिक्त लचीलेपन के लिए हिंज (hinge) क्षेत्र होता है, जबकि μ और ε भारी श्रृंखलाओं का स्थिर क्षेत्र चार इम्युनोग्लोबुलिन प्रभाव क्षेत्र से बना होता है। भारी श्रृंखला का अस्थिर क्षेत्र विभिन्न बी कोशिकाओं (B cells) द्वारा उत्पादित प्रतिपिंडों (एंटीबॉडी) के अनुसार अलग होता है, किन्तु एकल बी कोशिका (B Cell) या बी कोशिका क्लोन (B Cell clone) द्वारा उत्पादित सभी एंटीबॉडी के लिए समान होता है। प्रत्येक भारी श्रृंखला का अस्थिर क्षेत्र 110 अमीनो अम्ल जितना लंबा होता है और एकल आईजी/Ig प्रभाव क्षेत्र से बना होता है।
हल्की श्रृंखला
स्तनधारियों में दो प्रकार की इम्युनोग्लोबुलिन हल्की श्रृंखलाएं होती हैं जिन्हें लैम्ब्डा (lambda/λ) और कप्पा (kappa/κ) कहा जाता है। एक हल्की श्रृंखला के दो क्रमिक प्रभाव क्षेत्र हैं : एक स्थिर प्रभाव क्षेत्र और एक अस्थिर प्रभाव क्षेत्र. हल्की श्रृंखला की लंबाई लगभग 211 से 217 अमीनो अम्ल होती है। प्रत्येक प्रतिपिंड (एंटीबॉडी) में दो हल्की श्रृंखलाएं होती हैं, जो सदैव एक जैसी होती हैं; स्तनधारियों में एक प्रतिपिंड (एंटीबॉडी) में केवल एक प्रकार की हल्की श्रृंखला κ या λ मौजूद होती हैं। दूसरे प्रकार की हल्की श्रृंखलाएं जैसे कि आयोटा (iota/ι) श्रृंखला, निचली श्रेणी के रीढ़धारियों जैसे कॉन्ड्रिकथायिस (Chondrichthyes) और टेलीऑस्टेई (Teleostei) में पाई जाती हैं।
सीडीआर/CDR, एफवी/FV, फैब (Fab) और एफसी/Fc क्षेत्र
प्रतिपिंड (एंटीबॉडी) के कुछ हिस्सों के विशिष्ट कार्य हैं। उदाहरण के लिए, Y की बाहों में वो स्थान होता है जो एंटीजन को बांधता है और इस प्रकार, विशिष्ट बाहरी वस्तुओं को पहचानता है। प्रतिपिंड (एंटीबॉडी) के इस क्षेत्र को फैब (Fab)(फ्रेगमेंट, एंटीजन बाइंडिंग) क्षेत्र कहा जाता है। यह एंटीबॉडी की प्रत्येक भारी तथा हल्की श्रृंखला के एक स्थिर तथा एक अस्थिर क्षेत्र से मिल कर बना होता है। पैराटोप (paratope) हल्की व भारी श्रृंखलाओं के विभिन्न प्रभाव क्षेत्र द्वारा एंटीबॉडी मोनोमर (monomer) के अमीनो टर्मिनल छोर पर स्थित होता है। अस्थिर क्षेत्र को एफवी/FV क्षेत्र भी कहा जाता है और यह एंटीजन को जोड़ने के लिए सबसे महत्त्वपूर्ण क्षेत्र है। विशेष रूप से हल्की (वीएल/VL और भारी (वीएच/VH) श्रृंखलाओं पर स्थित प्रत्येक तीन अस्थिर छल्ले, जो एंटीजन को बाँधने के लिए जिम्मेदार हैं। ये छल्ले उत्प्रेरक निर्धारण क्षेत्र (सीडीआर/CDR) कहलाते हैं। प्रतिरक्षा नेटवर्क सिद्धांत की संरचना में, सीडीआर/CDR को इडियोटाइप (idiotypes) भी कहा जाता है। प्रतिरक्षा नेटवर्क सिद्धांत के अनुसार, इडियोटाइप (idiotypes) की प्रक्रियाओं द्वारा अनुकूलन प्रतिरक्षा प्रणाली विनयमित होती है।
Y का आधार प्रतिरक्षा (immune) कोशिका की गतिविधि को व्यवस्थित करता है। यह क्षेत्र एफसी/Fc (फ्रेगमेंट, क्रिस्टललाइज़ेबल) क्षेत्र कहलाता है और यह दो भारी श्रृंखलाओं से मिल कर बना है, जो प्रतिपिंड (एंटीबॉडी) के वर्ग के आधार पर दो या तीन स्थिर प्रभाव क्षेत्र का योगदान देते हैं। किसी विशेष प्रोटीन के साथ जुड़ कर एफसी/Fc क्षेत्र यह सुनिश्चित करता है की प्रत्येक प्रतिपिंड (एंटीबॉडी) दिए गये प्रतिजन (एंटीजन) के प्रति उपयुक्त प्रतिरक्षा (immune) प्रतिक्रिया करे. एफसी/Fc क्षेत्र दूसरे कोशिका रिसेप्टर जैसे एफसी/Fc रिसेप्टर तथा दूसरे प्रतिरक्षा (immune) अणुओं जैसे पूरक प्रोटीनों के साथ भी जुड़ता है। ऐसा करने से, यह ऑप्सोनाइज़ेशन (opsonization), कोशिका अपघटन सहित विभिन्न शारीरिक प्रभावों की मध्यस्थता करता है, जिनमे मास्ट कोशिकाओं, संयोजी ऊत्तक कोशिकाओं (basophils) तथा सफ़ेद रक्त कोशिकाओं (eosinophils) का डिग्रेन्युलेशन (degranulation) शामिल है।
कार्यप्रणाली
सक्रिय बी कोशिकाएं (B cells) या तो घुलनशील एंटीबॉडी में स्रावित होने वाली प्रतिपिंड (एंटीबॉडी) उत्पादक कोशिकाओं, जिन्हें प्लाविका कोशिकाएं भी कहते हैं, में या शरीर में लम्बे समय तक बनी रहने वाली स्मृति कोशिकाओं में अंतर करती हैं, ताकि प्रतिरक्षा प्रणाली प्रतिजन (एंटीजन) को याद रख सके तथा इनके पुनः प्रकट होने पर त्वरित प्रतिक्रिया कर सके.
जीवन के जन्मपूर्व और नवजात चरणों में, प्रतिपिंड (एंटीबॉडी) मां से निष्क्रिय टीकाकरण द्वारा प्राप्त होते हैं। शुरूआती अन्तर्जात प्रतिपिंड उत्पादन विभिन्न प्रकार के प्रतिपिंडों (एंटीबॉडी) के लिए अलग अलग होता है और सामान्यतः जीवन के प्रथम वर्ष के भीतर प्रकट होता है। चूंकि प्रतिपिंड (एंटीबॉडी) रक्तधारा में स्वतंत्र होते हैं, इन्हें शारीरिक प्रतिरक्षा प्रणाली का ही भाग कहा जाता है। प्रवाह करने वाले प्रतिपिंड (एंटीबॉडी) क्लोनल बी कोशिकाओं (clonal B cells) द्वारा उत्पन्न किये जाते हैं जो विशेष रूप से केवल एक प्रतिजन (एंटीजन) के लिए प्रतिक्रिया करती हैं (वायरस कैप्सिड प्रोटीन विखंडन एक उदाहरण है). प्रतिपिंड (एंटीबॉडी) तीन तरह से रोगनाशक क्षमता के प्रति योगदान देते हैं। वे रोगकारकों (pathogens) के साथ जुड़ कर उन्हें कोशिकाओं में घुसने या नष्ट करने से रोकते हैं; वे श्वेत रक्त कोशिकाओं (macrophages) तथा अन्य कोशिकाओं को रोगकारक (pathogen) की कोटिंग द्वारा रोगकारकों (pathogens) को नष्ट करने के लिए उत्तेजित करते हैं; और वे रोगकारकों (pathogens) का विनाश शुरु करने के लिए दूसरी रोगनाशक प्रतिक्रियाओं जैसे उत्प्रेरक मार्ग को उत्तेजित करते हैं।
उत्प्रेरकों का सक्रियकरण
प्रतिजन (एंटीजन) की सतह से जुड़ने वाले प्रतिपिंड (एंटीबॉडी), उदाहरण के लिए एक जीवाणु, उत्प्रेरक प्रक्रिया के पहले घटक को अपने एफसी/Fc क्षेत्र से आकर्षित करते हैं और "उत्कृष्ट" उत्प्रेरक प्रणाली के सक्रियण की शुरुआत करते हैं। इसके परिणामस्वरूप जीवाणु दो तरह से मरता है। पहले तरीके में, ऑस्पोनाइज़ेशन प्रक्रिया द्वारा प्रतिपिंड (एंटीबॉडी) और उत्प्रेरक अणु, सूक्ष्मजीव को फैगोसाइट (phagocytes) द्वारा खाने के लिए चिन्हित करते हैं, ये फैगोसाइट (phagocytes) उत्प्रेरक प्रक्रिया से उत्पन्न उत्प्रेरक अणुओं द्वारा आकर्षित होते हैं। दूसरे तरीके में, उत्प्रेरक प्रणाली के कुछ घटक जीवाणुओं को सीधे मारने में प्रतिपिंड (एंटीबॉडी) की सहायता के लिए झिल्लीनुमा आक्रामक समूह बना लेते हैं।
प्रेरक कोशिकाओं का सक्रियण
कोशिकाओं के बाहर स्वयं को दोहराने वाले रोगकारकों का मुकाबला करने के लिए, प्रतिपिंड (एंटीबॉडी) उन्हें आपस में इकठ्ठा करने के लिए एक साथ बांध देते हैं, जिससे वे चिपक जाते हैं। चूंकि एक प्रतिपिंड (एंटीबॉडी) के कम से कम दो पैराटोप (paratope) होते हैं, ये इन प्रतिजनों (एंटीजन) की सतह पर स्थित समान एपिटोप (epitopes) को जोड़ कर कर एक से अधिक प्रतिजन (एंटीजन) को बांध सकते हैं। रोगकारकों (pathogens) की कोटिंग द्वारा, एंटीबॉडी कोशिकाओं में उन प्रेरक कार्यों को रोगकारकों के खिलाफ उत्तेजित करते हैं जो उनका एफसी/Fc क्षेत्र पहचानते हैं।
कोटेड रोगकारकों (pathogens) को पहचानने वाली कोशिकाओं में एफसी/Fc रिसेप्टर होते हैं, जैसा कि नाम से स्पष्ट है - आईजीए (IgA), आइजीजी (IgG) और आइजीई (IgE) प्रतिपिंडों (एंटीबॉडी) के एफसी/Fc क्षेत्र के साथ प्रक्रिया करते हैं। किसी विशेष कोशिका पर एफसी/Fc रिसेप्टर के साथ किसी विशेष प्रतिपिंड (एंटीबॉडी) का जुड़ाव उस कोशिका में प्रेरक क्रिया को बढ़ावा देता है, फैगोसाइट (phagocytes) फैगोसाइटोस (phagocytose) हो जाएगा, मास्ट कोशिकाएं और न्यूट्रोफिल्स (neutrophils) डिग्रेन्युलेट हो जायेंगी, प्राकृतिक हत्यारी कोशिकाएं साइटोकिन (cytokines) व साइटोटॉक्सिक (cytotoxic) अणु छोड़ेंगी जो अंततः हमलावर सूक्ष्म जीवों का विनाश करेंगी. एफसी/Fc रिसेप्टर आइसोटाइप पर आधारित हैं जो विशिष्ट रोगकारकों के लिए केवल उपयुक्त प्रतिरक्षा (immune) तंत्र को जागृत करते हैं, जिससे रोगनाशक प्रणाली को अत्यधिक लचीलापन मिलता है।
प्राकृतिक प्रतिपिंड (एंटीबॉडी)
मनुष्य और इससे ऊपर के स्तर के स्तनधारी भी "प्राकृतिक प्रतिपिंड" उत्पन्न करते हैं जो वायरल संक्रमण से पहले सीरम में मौजूद रहते हैं। प्राकृतिक एंटीबॉडी वे प्रतिपिंड (एंटीबॉडी) हैं जो बिना किसी पिछले संक्रमण, टीकाकरण, अन्य बाहरी प्रतिजन (एंटीजन) से संपर्क या निष्क्रिय टीकाकरण द्वारा उत्पन्न होते हैं। ये एंटीबॉडी उत्कृष्ट उत्प्रेरक मार्ग को सक्रिय कर वायरस कणों को अनुकूलन प्रतिरक्षा प्रक्रिया के सक्रिय होने से पहले अपघटित कर सकते हैं। कई प्राकृतिक प्रतिपिंडों (एंटीबॉडी) को डाईसैकराइड ग्लेक्टोज़ (disaccharide galactose) α(1,3)-ग्लेक्टोज़ (galactose) (α-Gal) के खिलाफ निर्देशित किया जाता है, जो ग्लाइकोसाइलेटेड (glycosylated) सेल सरफेस प्रोटीन पर टर्मिनल शुगर के रूप में पाए जाते हैं और मनुष्य की आंत में स्थित जीवाणुओं द्वारा इस शुगर के उत्पादन के खिलाफ उत्पन्न होते हैं। माना जाता है कि अंगों के प्रत्यारोपण की अस्वीकृति इसी कारण से होती है कि प्राप्तकर्ता के सीरम में प्रवाहित प्राकृतिक प्रतिपिंड (एंटीबॉडी) दानकर्ता के ऊतकों के α-Gal प्रतिजनों (एंटीजन) के साथ जुड़ जाते हैं।
इम्युनोग्लोबुलिन विविधता
लगभग सभी रोगाणु एंटीबॉडी प्रक्रिया को शुरू कर सकते हैं। कई विभिन्न तरह के रोगाणुओं को सफलतापूर्वक पहचानने तथा ख़त्म करने के लिए प्रतिपिंडों (एंटीबॉडी) में विविधता होनी चाहिए, इसलिए उनकी अमीनो अम्ल संरचना में विविधता पाई जाती है जो उन्हें कई प्रकार के प्रतिजनों (एंटीजन) से प्रतिक्रिया करने के लिए सक्षम बनाती है। ऐसा अनुमान है कि मनुष्य लगभग 10 अरब प्रकार के विभिन्न प्रतिपिंड (एंटीबॉडी) उत्पन्न करते हैं, जिनमें से प्रत्येक एक एंटीजन के विशिष्ट एपिटोप (epitope) के साथ जुड़ने में सक्षम है। हालांकि एक व्यक्ति विभिन्न प्रतिपिंडों (एंटीबॉडी) की विशाल मात्रा उत्पन्न करता है, इन प्रोटीनों को बनाने वाले जीन व्यक्ति के जीनोम के अनुसार सीमित होते हैं। कई जटिल आनुवांशिक तंत्र विकसित हुए हैं जो रीढ़धारी की बी कोशिकाओं (B cells) को एंटीबॉडी जीन की अपेक्षाकृत कम मात्रा से विविध प्रकार के एंटीबॉडी समूह बनाने की अनुमति देते हैं।
प्रभाव-क्षेत्र में परिवर्तनशीलता
गुणसूत्र का क्षेत्र (locus) जो प्रतिपिंड (एंटीबॉडी) को कूटबद्ध करता है, विशाल है और इसमें प्रतिपिंड (एंटीबॉडी) के प्रत्येक प्रभाव क्षेत्र के लिए अलग अलग प्रकार के विशिष्ट जीन पाए जाते हैं, वह स्थान जहां भारी श्रृंखला वाले जीन (आईजीएच@/IGH@) होते हैं, गुणसूत्र 14 पर पाया जाता है और वह स्थान जहां लैम्ब्डा और कप्पा हल्की श्रृंखला वाले जीन (आईजीएल@/IGL@ व आईजीके@/IGK@) होते हैं, मनुष्यों में गुणसूत्र 22 व 2 पर पाया जाता है। इन प्रभाव क्षेत्र में से एक प्रभाव क्षेत्र अस्थिर प्रभाव क्षेत्र कहलाता है जो प्रत्येक प्रतिपिंड (एंटीबॉडी) की प्रत्येक भारी तथा हल्की श्रृंखला में उपस्थित है, किन्तु विभिन्न बी कोशिकाओं (B cells) द्वारा उत्पन्न विभिन्न प्रतिपिंडों (एंटीबॉडी) में अलग अलग हो सकता है। अस्थिर प्रभाव क्षेत्र के बीच अंतर तीन छल्लों पर स्थित होता है जिन्हें अत्यंत परिवर्तनशील क्षेत्र (hypervariable regions) (एचवी-1/HV-1, एचवी-2/HV-2 या एचवी-3/HV-3) या उत्प्रेरक निर्धारण क्षेत्र (सीडीआर1/CDR1, सीडीआर2/CDR2 या सीडीआर3/CDR3) कहते हैं। अस्थिर प्रभाव क्षेत्र में संरक्षित ढांचों के क्षेत्र सीडीआर/CDR के सहायक होते हैं। भारी श्रृंखला के स्थान पर लगभग 65 विभिन्न तरह के प्रभाव क्षेत्र जीन होते हैं जिनके सीडीआर/CDR अलग-अलग होते हैं। इन जीनों को प्रतिपिंड (एंटीबॉडी) के दूसरे प्रभाव क्षेत्र के प्रतिपिंड (एंटीबॉडी) के जीनों के समूह में मिलाने से उच्च विविधता वाले प्रतिपिंडों (एंटीबॉडी) की एक विशाल तादाद उत्पन्न होती है। यह संयोजन वी (डी) जे (V(D)J) पुर्नसंयोजन कहलाता है जिसके बारे में नीचे चर्चा की गयी है।
वी (डी) जे (V(D)J) पुर्नसंयोजन
इम्युनोग्लोबुलिन का शारीरिक पुर्नसंयोजन, जो वी (डी) जे (V(D)J) पुर्नसंयोजन के नाम से भी जाना जाता है, विशिष्ट इम्युनोग्लोबुलिन अस्थिर क्षेत्र के निर्माण में शामिल होता है। भारी तथा हल्की श्रृंखला के प्रत्येक इम्युनोग्लोबुलिन का अस्थिर क्षेत्र कई हिस्सों में कूटबद्ध होता है - जिन्हें जीन खंड के रूप में जाना जाता है। इन खण्डों को अस्थिर (वी/V), विविध (डी/D) और संयोजक (जे/J) खंड कहा जाता है। वी (V), डी (D) और जे (J) खंड, आईजी/Ig भारी श्रृंखलाओं में पाए जाते हैं, किन्तु केवल वी (V) तथा जे (J) खंड ही आईजी/Ig हल्की श्रृंखलाओं में मिलते हैं। वी (V), डी (D) और जे (J) खण्डों की एकाधिक प्रतियां उपलब्ध होती हैं और स्तनधारियों के जीनोम में अग्रानुक्रम में व्यवस्थित हैं। अस्थि मज्जा में विकसित होने वाली प्रत्येक बी कोशिका (B Cell) क्रम रहित चुनाव तथा एक वी/(V), एक डी (D) और एक जे (J) जीन खण्डों (या हल्की श्रृंखला में एक वी (V) और एक जे (J) जीन खण्डों) के संयोजन द्वारा एक इम्युनोग्लोबुलिन क्षेत्र को जोड़ेगी. क्योंकि प्रत्येक जीन खंड की एकाधिक प्रतियां हैं और प्रत्येक इम्युनोग्लोबुलिन अस्थिर क्षेत्र को बनाने के लिए जीन खण्डों के अलग अलग संयोजनों का प्रयोग किया जा सकता है, यह प्रक्रिया विशाल मात्रा में प्रतिपिंड (एंटीबॉडी) उत्पन्न करती है जिनमे से प्रत्येक का पैराटोप (paratope) अलग होता है और इसलिए प्रतिजन (एंटीजन) विशेषताओं में विभिन्नता होती है।
वी (डी) जे (V(D)J) पुर्नसंयोजन के दौरान बी कोशिका (B Cell) द्वारा, एक कार्यात्मक इम्युनोग्लोबुलिन जीन उत्पन्न करने के बाद, यह किसी और अस्थिर क्षेत्र को व्यक्त नहीं कर सकती (एक प्रक्रिया जो एलेलिक अपवाद (allelic exclusion) के नाम से जानी जाती है), इसलिए प्रत्येक बी कोशिका (B Cell) केवल एक प्रकार की अस्थिर श्रृंखलाओं वाले प्रतिपिंड (एंटीबॉडी) उत्पन्न कर सकती है।
दैहिक अतिउत्परिवर्तन एवं आकर्षण (एफिनिटी) की परिपक्वता
- इस विषय पर अधिक जानकारी के लिए देखें - दैहिक अतिउत्परिवर्तन व आकर्षण (एफिनिटी) की परिपक्वता
एंटीजन से सक्रियण के बाद, बी कोशिकाएं (B cells) संख्या में तेज़ी से बढ़ने लगती हैं। इन तेज़ी से विभाजित होती कोशिकाओं में, भारी तथा हल्की श्रृंखलाओं के अस्थिर प्रभाव क्षेत्र को कूटबद्ध करने वाले जीन एक प्रक्रिया द्वारा उच्च दर के परिवर्तन बिंदु से गुज़रते हैं, जिसे सोमेटिक हाइपरम्यूटेशन (somatic hypermutation) (एसएचएम/SHM) कहा जाता है। एसएचएम/SHM के परिणामस्वरूप प्रत्येक कोशिका डिवीजन में प्रति अस्थिर जीन लगभग एक न्युक्लियोटाइड बदलता है। परिणामस्वरूप, कोई भी संतान बी कोशिकाएं (B cells) अपनी प्रतिपिंड (एंटीबॉडी) श्रृंखलाओं के विभिन्न प्रभाव क्षेत्रों में मामूली अमीनो अम्ल अंतर हासिल करेगी.
इससे प्रतिपिंड (एंटीबॉडी) समूह की विविधता बढती है और यह प्रतिपिंड (एंटीबॉडी) द्वारा प्रतिजन (एंटीजन) को आकर्षित करने की क्षमता को प्रभावित करता है। किसी बिंदु पर परिवर्तनों के कारण ऐसे प्रतिपिंड (एंटीबॉडी) उत्पन्न होंगे जिनकी मूल प्रतिपिंड (एंटीबॉडी) की अपेक्षा अपने प्रतिजन (एंटीजन) से प्रतिक्रिया क्षमता कमज़ोर (कम आकर्षण) होगी और कुछ परिवर्तन शक्तिशाली प्रतिक्रिया (उच्च आकर्षण) वाले प्रतिपिंड (एंटीबॉडी) उत्पन्न करेंगे. बी कोशिकाएं (B cells) जो अपनी सतह पर उच्च आकर्षण वाले प्रतिपिंड (एंटीबॉडी) व्यक्त करती हैं, उन्हें दूसरी कोशिकाओं के साथ प्रतिक्रिया के दौरान जीवित रहने के मज़बूत संकेत मिलेंगें जबकि कम आकर्षण वाले प्रतिपिंड (एंटीबॉडी) को यह संकेत नहीं मिलेंगे और एपॉपटोसिस (apoptosis) द्वारा समाप्त हो जाएंगे. इस प्रकार प्रतिजन (एंटीजन) के प्रति उच्च आकर्षण वाले प्रतिपिंड (एंटीबॉडी) व्यक्त करने वाली बी कोशिकाएं (B cells), कार्य तथा जीवन की दौड़ में कम आकर्षण वाले प्रतिपिंडों (एंटीबॉडी) को पछाड़ देंगी. अधिक जुड़ाव आकर्षण वाले एंटीबॉडी उत्पन्न करने की प्रक्रिया को एफिनिटी मैच्योरेशन कहा जाता है। एफिनिटी मैच्योरेशन परिपक्व बी कोशिकाओं (B cells) में वी (डी) जे (V(D)J) पुर्नसंयोजन के बाद होता है और यह सहायक टी (T) कोशिकाओं से मिलने वाली सहायता पर निर्भर है।
वर्ग परिवर्तन
आइसोटाइप या वर्ग परिवर्तन एक जैविक प्रक्रिया है जो बी कोशिकाओं (B cells) के सक्रिय होने के बाद घटित होती है तथा जो कोशिका को विभिन्न वर्गों के प्रतिपिंड (एंटीबॉडी) (आईजीए (IgA), आइजीई (IgE) या, आइजीजी (IgG)) उत्पन्न करने की अनुमति देती है। प्रतिपिंड (एंटीबॉडी) के विभिन्न वर्गों और प्रेरक कार्यों को इम्युनोग्लोबुलिन की भारी श्रृंखला के 'स्थिर' (C) क्षेत्रों द्वारा परिभाषित किया जाता है। प्रारम्भ में सीधी सादी बी कोशिकाएं (B cells) समान एंटीजन जुड़ाव क्षेत्रों के साथ केवल कोशिका सतह आईजीएम (IgM) व आईजीडी (IgD) को ही व्यक्त करती हैं। प्रत्येक आइसोटाइप एक अलग कार्य के लिए अनुकूलित है, इसलिए सक्रियण के पश्चात् एक प्रतिजन (एंटीजन) को प्रभावशाली ढंग से समाप्त करने के लिए आइजीजी (IgG), आईजीए (IgA) या आइजीई (IgE) उत्प्रेरक सुविधा युक्त एक प्रतिपिंड (एंटीबॉडी) की आवश्यकता हो सकती है। वर्ग परिवर्तन समान रूप से सक्रिय बी कोशिका (B Cell) की विभिन्न संतान कोशिकाओं को विभिन्न प्रकारों के आइसोटाइप उत्पन्न करने की अनुमति देता है। वर्ग परिवर्तन के दौरान, प्रतिपिंड (एंटीबॉडी) भारी श्रृंखला का केवल स्थिर क्षेत्र बदलता है, अस्थिर क्षेत्र या विशेष रूप से प्रतिजन (एंटीजन) अपरिवर्तित रहते हैं। इस प्रकार एकल बी कोशिका (B Cell) के वंशज समान प्रतिजन (एंटीजन) के लिए विशिष्ट किन्तु प्रत्येक एंटिजेनिक चुनौती के लिए उपयुक्त प्रेरक क्रिया उत्पन्न करने की क्षमता के साथ प्रतिपिंड (एंटीबॉडी) उत्पन्न कर सकते हैं। वर्ग परिवर्तन साइटोकिन्स (cytokines) द्वारा शुरू होता है, उत्पन्न होने वाले आइसोटाइप इस बात पर निर्भर करते हैं कि बी कोशिकाओं (B cells) के वातावरण में कौन से साइटोकिन्स (cytokines) मौजूद हैं।
भारी श्रृंखला जीन स्थान (locus) में वर्ग परिवर्तन पुनर्संयोजन (CSR) तंत्र द्वारा वर्ग परिवर्तन होता है। यह तंत्र संरक्षित न्युक्लियोटाइड रूपांकनों पर निर्भर करता है, जिन्हें स्विच (एस/S) क्षेत्र कहते हैं तथा जो प्रत्येक स्थिर क्षेत्र जीन के डीएनए (DNA) अपस्ट्रीम में (δ-श्रृंखला को छोड़ कर) पाया जाता है। दो चुने हुए एस/S क्षेत्रों में एंजाइमों की श्रृंखला की गतिविधि द्वारा डीएनए (DNA) किनारे तोड़े जाते हैं। अस्थिर प्रभाव क्षेत्र एक्सॉन (exon) को वांछित स्थिर क्षेत्र (γ, α या ε) से गैर समरूप सिरे जोड़ना (non-homologous end joining) (NHEJ) नामक प्रक्रिया द्वारा पुनः जोड़ा जाता है। इस प्रक्रिया का परिणाम एक इम्युनोग्लोबुलिन जीन के रूप में सामने आता है जो अलग आइसोटाइप के प्रतिपिंड (एंटीबॉडी) को कूटबद्ध करता है।
चिकित्सीय अनुप्रयोग
रोग निदान और उपचार
विशेष प्रतिपिंड (एंटीबॉडी) का पता लगाना चिकित्सीय विश्लेषण का सबसे आम प्रकार है और सेरोलॉजी जैसे अनुप्रयोग इन तरीकों पर निर्भर हैं। उदाहरण के लिए, जैव रासायनिक परख में बीमारी के विश्लेषण के लिए, एंटीबॉडी का टिटर (titer), एपस्तीन-बार वायरस (Epstein-Barr virus) के खिलाफ़ छोड़ा जाता है या रक्त से लाइम बीमारी का अनुमान लगाया जाता है। अगर ये प्रतिपिंड (एंटीबॉडी) मौजूद नहीं हो, तो या तो व्यक्ति संक्रमित नहीं है, या फिर संक्रमण बहुत समय पहले हुआ था और इन विशेष प्रतिपिंडों (एंटीबॉडी) को उत्पन्न करने वाली बी कोशिकाएं (B cells) प्राकृतिक रूप से नष्ट हो चुकी हैं। चिकित्सीय प्रतिरक्षा विज्ञान में, रोगी के प्रतिपिंड (एंटीबॉडी) प्रोफ़ाइल को पहचानने के लिए इम्युनोग्लोबुलिन के अलग अलग वर्गों के स्तर को नेफ्लोमेट्री (nephelometry) (या टर्बायडिमेट्री (turbidimetry) द्वारा मापा जाता है। इम्युनोग्लोबुलिन के विभिन्न वर्गों में बढ़ोत्तरी कई बार उन रोगियों के जिगर में नुकसान के कारण का पता लगाने में सहायक होती है जिनका निदान अस्पष्ट है। उदाहरण के लिए, बढ़ा हुआ आईजीए/IgA एल्कोहोलिक सिरोसिस का संकेत करता है, बढ़ा हुआ आईजीएम (IgM) वायरल हैपेटाइटिस और प्राथमिक पित्त सिरोसिस का संकेत करता है, जबकि वायरल हैपेटाइटिस, ऑटोइम्यून हैपेटाइटिस और सिरोसिस में आईजीजी/IgG बढ़ जाता है। ऑटोइम्यून विकार अक्सर उन प्रतिपिंडों (एंटीबॉडी) की वजह से हो सकते हैं जो शरीर के अपने एपिटोप (epitope) को बांधते हैं; इनमें से बहुतों का रक्त की जांच से पता लगाया जा सकता है। प्रतिरक्षा (immune) मध्यस्थता वाले हीमोलाइटिक एनीमिया में लाल रक्त कोशिका के सतही एंटीजन के खिलाफ़ छोड़े गये एंटीबॉडी कूम्ब्स टेस्ट (Coombs Test) द्वारा पहचाने जाते हैं। रक्त संचार तैयारी तथा महिलाओं में प्रसव पूर्व स्क्रीनिंग के लिए भी कूम्ब्स टेस्ट किया जाता है। वास्तव में, जटिल एंटीजन-एंटीबॉडी की जांच पर आधारित कई इम्यूनोडायग्नोस्टिक तरीकों का प्रयोग संक्रामक बीमारी को पहचानने के लिए किया जाता है, उदाहरण के लिए एलिसा (ELISA), इम्यूनोफ्लोरेसेंस (immunofluorescence), वेस्टर्न ब्लॉट (Western blot), इम्यूनोडिफ्युज़न (immunodiffusion), इम्यूनोइलेक्ट्रोफोरेसिस (immunoelectrophoresis) तथा मैग्नेटिक इम्यूनोएस्से (Magnetic immunoassay). मानव कोरिओनिक गोनाडोट्रोपिन (Human chorionic gonadotropin) के खिलाफ छोड़े गये प्रतिपिंड (एंटीबॉडी) काउंटर गर्भावस्था परीक्षण में प्रयुक्त होते हैं। लक्षित मोनोक्लोनल प्रतिपिंड (एंटीबॉडी) चिकित्सा का प्रयोग वातज गठिया (rheumatoid arthritis), मल्टिपल स्क्लेरोसिस (multiple sclerosis), सोरायसिस (psoriasis) तथा नॉन-हॉकिन लिम्फोमा (non-Hodgkin's lymphoma) सहित कैंसर के कई प्रकारों, मलाशय के कैंसर (colorectal cancer), सिर व गर्दन के कैंसर तथा स्तन कैंसर जैसी बीमारियों के इलाज़ में किया जाता है। कुछ प्रतिरक्षा (immune) संबंधित बीमारियां, जैसे एक्स-लिंक्ड अगामाग्लोबुलिनेमिया (X-linked agammaglobulinemia) और हाइपोअगामाग्लोबुलिनेमिया (hypogammaglobulinemia), प्रतिपिंडों (एंटीबॉडी) की आंशिक या पूर्ण कमी के कारण होती हैं। इन बीमारियों का इलाज़ अक्सर छोटी अवधि में रोगनाशक क्षमता को उत्प्रेरित करके किया जाता है जिसे निष्क्रिय रोगनाशक क्षमता कहा जाता है। निष्क्रिय रोगनाशक क्षमता इकट्ठे किये गये इम्युनोग्लोबुलिन या मोनोक्लोनल एंटीबॉडी को मनुष्य या जानवर के सीरम के रूप में पहले से तैयार एंटीबॉडी को प्रभावित व्यक्ति में हस्तांतरण द्वारा प्राप्त की जाती है।
प्रसवपूर्व उपचार
रीसस फैक्टर, रीसस डी (आरएचडी/RhD) प्रतिजन (एंटीजन) के रूप में भी जाना जाता है, लाल रक्त कोशिकाओं में पाया जाने वाला प्रतिजन (एंटीजन) है; जो व्यक्ति रीसस पोज़िटिव (Rh+) होते हैं उनकी लाल रक्त कोशिकाओं में यह प्रतिजन (एंटीजन) होता है और जो व्यक्ति रीसस नेगेटिव (Rh–) होते हैं, उनमें यह नहीं होता. सामान्य प्रसव के दौरान, प्रसव आघात या गर्भावस्था की जटिलताओं के कारण, भ्रूण से रक्त, मां की शारीरिक प्रणाली में प्रवेश कर सकता है। आरएच/Rh-असंगत मां और बच्चे की स्थिति में, यह रक्त मिश्रण Rh- मां को Rh+ बच्चे की रक्त कोशिकाओं पर आरएच/Rh प्रतिजन (एंटीजन) के लिए संवेदनशील बना सकती हैं, जिससे प्रसव से उत्पन बच्चे और भविष्य में होने वाले प्रसवों के दौरान नवजात शिशुओं को हीमोलाइटिक नामक रोग हो सकता है।
आरएचओ (डी)/Rho(D) प्रतिरक्षा (immune) ग्लोबुलिन प्रतिपिंड (एंटीबॉडी) मानव के रीसस डी/D (आरएचडी/RhD) एंटीजन के लिए विशिष्ट हैं। एक रीसस-नेगटिव मां में रीसस-पोज़िटिव भ्रूण के कारण होने वाली संवेदनशीलता को रोकने के लिए प्रसव-पूर्व इलाज़ के रूप में एंटी-आरएचडी/RhD प्रतिपिंड (एंटीबॉडी) दिए जा सकते हैं। आघात तथा डिलीवरी से पहले तथा तुरंत बाद एंटी-आरएचडी/RhD एंटीबॉडी द्वारा मां का इलाज़ भ्रूण से मां की प्रणाली में जाने वाले आरएच/Rh एंटीजन को नष्ट करता है। महत्वपूर्ण रूप से, ऐसा एंटीजन द्वारा मातृ बी कोशिकाओं (B cells) को स्मृति बी कोशिकाएं (B cells) उत्पन्न कर आरएच (Rh) एंटीजन को "याद" (remember) रखने के लिए उत्तेजित करने से पहले होता है। इसलिए, उसकी प्रतिरक्षा प्रणाली एंटी-आरएच (Rh) प्रतिपिंड (एंटीबॉडी) नहीं बनाएगी, तथा वर्तमान या भविष्य के शिशुओं के रीसस प्रतिजन (एंटीजन) पर हमला नहीं करेगी. आरएचओ (डी) / Rho(D) प्रतिरक्षा (immune) ग्लोबुलिन उपचार संवेदनशीलता से बचाता है जो आरएच (Rh) बीमारी का कारण बन सकती है, लेकिन स्वयं अंतर्निहित बीमारी का बचाव या इलाज़ नहीं कर सकता.
अनुसंधान के अनुप्रयोग
स्तनधारियों में प्रतिजन (एंटीजन) डाल कर विशेष प्रतिपिंड (एंटीबॉडी) उत्पन्न किये जा रहे हैं जैसे प्रतिपिंडों (एंटीबॉडी) की छोटी मात्रा के लिए चूहे या खरगोश या बड़ी मात्रा के लिए बकरी, भेड़ या घोड़े का प्रयोग किया जाता है। इन जानवरों से निकाले गये रक्त के सीरम में पॉलीक्लोनल एंटीबॉडी - एकाधिक प्रतिपिंड (एंटीबॉडी) जो समान प्रतिजन (एंटीजन) से जुड़ते हैं - होते हैं, जिन्हें अब एंटीसीरम कहा जा सकता है। अंडे की जर्दी में पॉलीक्लोनल प्रतिपिंड (एंटीबॉडी) उत्पन्न करने के लिए भी मुर्गियों को एंटीजन के इंजेक्शन लगाए जाते हैं। प्रतिपिंड (एंटीबॉडी) जो एक प्रतिजन (एंटीजन) के एकल एपिटोप (epitope) के लिए विशिष्ट हो, को प्राप्त करने के लिए जानवर से एंटीबॉडी-स्रावित करने वाले लिम्फोसाइट अलग किये जाते हैं तथा उन्हें कैंसर कोशिका लाइन के साथ मिला कर अमर किया जाता है। इन मिली हुई कोशिकाओं को हाइब्रिडोमा कहा जाता है और ये लगातार वृद्धि करेंगी तथा उत्तकों में प्रतिपिंड (एंटीबॉडी) का स्राव करेंगी. समान प्रतिपिंड (एंटीबॉडी) उत्पन्न करने वाली कोशिका क्लोन उत्पन्न करने के लिए एकल हाइब्रिडोमा कोशिकाएं डिल्यूशन क्लोनिंग द्वारा अलग की जाती हैं; ये प्रतिपिंड (एंटीबॉडी) मोनोक्लोनल एंटीबॉडी कहलाते हैं। पॉलीक्लोनल और मोनोक्लोनल एंटीबॉडी को अक्सर प्रोटीन A/G या एंटीजन एफिनिटी क्रोमैटोग्राफी द्वारा शुद्ध किया जाता है।
अनुसंधान में, शुद्ध एंटीबॉडी का उपयोग कई अनुप्रयोगों में किया जाता है। आम तौर पर इनका सबसे अधिक प्रयोग इंट्रासेल्युलर और एक्स्ट्रासेल्युलर प्रोटीन को पहचानने तथा ढूंढने के लिए किया जाता है। एंटीबॉडी का उपयोग, कोशिका के प्रकारों में उनके द्वारा व्यक्त प्रोटीन द्वारा अंतर करने के लिए, फ्लो साइटोमीट्री में किया जाता है; विभिन्न प्रकार की कोशिकाएं अपनी सतह पर अलग अलग अणुओं के अलग अलग गुच्छों के (क्लस्टर) संयोजनों को व्यक्त करती हैं और अलग प्रकार के इंट्रासेल्युलर और स्रावित किये जाने वाले प्रोटीन का निर्माण करती हैं। इनका प्रयोग प्रतिरक्षक अवक्षेपण द्वारा कोशिका अपघटन में दूसरे अणुओं से प्रोटीनों या उनसे जुडी किसी भी चीज़ (सह-प्रतिरक्षक अवक्षेपण) को अलग करने के लिए, वेस्टर्न ब्लॉट विश्लेषण में इलेक्ट्रोफोरेसिस द्वारा अलग किये गये प्रोटीनों को पहचानने के लिए, तथा प्रतिपिंड ऊतक रसायन विज्ञान या इम्यूनोफ्लोरेसेंस में ऊत्तक के खण्डों में प्रोटीन अभिव्यक्ति को जांचने या सूक्ष्मदर्शी की सहायता से कोशिकाओं के अन्दर प्रोटीन को ढूंढने के लिए भी किया जा रहा है। एलिसा (ELISA) और एलीस्पॉट (ELISPOT) तकनीकों का प्रयोग करके एंटीबॉडी की सहायता से भी प्रोटीन ढूंढें और मापे जा सकते हैं।
संरचना अनुमान
स्वास्थ्य देखभाल और जैव प्रौद्योगिकी उद्योग में एंटीबॉडी का महत्व उच्च स्तर पर उनकी संरचना के ज्ञान की मांग करता है। इस जानकारी का उपयोग प्रोटीन इंजीनियरिंग, एंटीजन बाइंडिंग एफिनिटी के संशोधन और किसी प्रतिपिंड (एंटीबॉडी) के एपिटोप को पहचानने के लिए किया जाता है। एक प्रतिपिंड (एंटीबॉडी) संरचनाओं के निर्धारण के लिए एक्स-रे क्रिस्टेलोग्राफी आम तौर पर प्रयोग की जाने वाली विधि है। हालांकि, एक प्रतिपिंड (एंटीबॉडी) को क्रिस्टलाइज़ करना अक्सर कठिन और लम्बा काम होता है। अभिकलानात्म्क (कम्प्युटेशनल) दृष्टिकोण क्रिस्टेलोग्राफी का सस्ता विकल्प प्रदान कर सकते हैं, लेकिन इनके परिणाम अधिकतर अस्पष्ट होते हैं क्योंकि वे अनुभवजन्य संरचनाओं का उत्पादन नहीं करते. वेब एंटीबॉडी मॉडलिंग (WAM) तथा प्रेडिक्शन ऑफ़ इम्यूनोग्लोबुलिन स्ट्रक्चर (PIGS) जैसे ऑनलाइन वेब सर्वर, एंटीबॉडी अस्थिर क्षेत्रों की कम्प्युटेशनल मॉडलिंग को संभव बनाते हैं। रोसेट्टा एंटीबॉडी एक नोवेल एंटीबॉडी एफवी/FV क्षेत्र संरचना वाला प्रेडिक्शन सर्वर है, जिसमे सीडीआर/CDR छल्लों को कम करने तथा हल्की व भारी श्रृंखलाओं के अभिविन्यास को बढ़ाने के साथ होमोलॉजी मॉडल जैसी आधुनिक तकनीकें शामिल हैं जो एंटीबॉडी के विशिष्ट एंटीजन के साथ सफल डॉकिंग का अनुमान लगाती हैं।
इतिहास
- इन्हें भी देखें: रोगक्षम विज्ञान का इतिहास
"एंटीबॉडी" शब्द का उल्लेख सबसे पहले पॉल इहर्लिश के लेख में मिलता है। एंटीकोर्पर (antikörper) (एंटीबॉडी के लिए जर्मन शब्द) शब्द, अक्टूबर 1891 में प्रकाशित उसके लेख "एक्सपेरिमेंटल स्टडीज़ ऑन इम्युनिटी" (Experimental Studies on Immunity) के अंत में प्रकट होता है, जिसमें कहा गया है कि "यदि दो पदार्थ दो विभिन्न एंटीकोर्पर को बढ़ावा देते हैं, तो वे आपस में अवश्य ही अलग अलग होने चाहिएं".. हालांकि, शब्द को तुरंत ही स्वीकार नहीं किया गया और एंटीबॉडी के लिए कई दूसरे शब्द प्रस्तावित किये गये, जिनमे इम्यूनकोर्पर (Immunkörper), एम्बोसेप्टर (Amboceptor), विशेनकोर्पर (Zwischenkörper), सबस्टांस सेंसिबिलीसेट्रिस (substance sensibilisatric), कोपुला (copula), डेस्मोन (Desmon), फिलोसाइटेस (philocytase), फिक्सेचर (fixateur) तथा इम्युनिज़्म (Immunisin) जैसे शब्द शामिल थे।एंटीबॉडी शब्द औपचारिक रूप से एंटीटॉक्सिन (antitoxin) शब्द के समान है और इसकी अवधारणा इम्यूनकोर्पर (Immunkörper) के समान है।

एंटीबॉडी के अध्ययन की शुरुआत 1890 में हुई, जब एमिल वॉन बेहरिंग और शिबासाबुरो कितासातो ने डिप्थीरिया और टेटनस के विष के खिलाफ़ प्रतिपिंड (एंटीबॉडी) की प्रक्रिया का वर्णन किया। बेहरिंग और कितासातो ने यह कह कर शारीरिक प्रतिरक्षा (hyumoral immunity) का सिद्धांत पेश किया कि सीरम में मध्यस्थ बाह्य प्रतिजनों के साथ प्रतिक्रिया कर सकते हैं। उनके विचार ने 1897 में पॉल इहर्लिश को प्रतिपिंड और प्रतिजन के लिए पक्ष श्रृंखला सिद्धांत (side chain theory) पेश करने के लिए प्रेरित किया, जब उन्होनें धारणा व्यक्त की कि कोशिकाओं की सतह पर रिसेप्टर्स ("साइड चेन" के रूप में वर्णित), "लॉक-एंड-की" (lock-and-key) क्रिया द्वारा विषाक्त पदार्थों को विशेष तरीके से बांध सकते थे - और यह बाध्यकारी क्रिया प्रतिपिंडों (एंटीबॉडी) के उत्पादन की मुख्य वजह थी। अन्य शोधकर्ताओं का मानना था कि प्रतिपिंड (एंटीबॉडी) रक्त में स्वतंत्र रूप से पाए जाते हैं और 1904 में, एल्मरोथ राइट ने बताया कि घुलनशील प्रतिपिंड (एंटीबॉडी) ने बैक्टीरिया को 2}फागोसाइटोसिस (phagocytosis) तथा मारने के लिए लेपित किया था; एक प्रक्रिया जिसे उन्होनें ओस्पोनाइनीज़ेशन (opsoninization) का नाम दिया.
1920 के दशक में, माइकल हाइडलबर्गर और ओसवाल्ड एवरी ने पाया कि प्रतिजनों (एंटीजन) को प्रतिपिंडों (एंटीबॉडी) द्वारा अलग किया जा सकता था और दिखाया कि प्रतिपिंड (एंटीबॉडी) प्रोटीन के बने थे। 1930 के दशक के अंत में जॉन मर्राक द्वारा प्रतिजन (एंटीजन)-प्रतिपिंड (एंटीबॉडी) प्रक्रियाओं के जैव रासायनिक गुणों का गहन निरीक्षण किया गया। अगली प्रमुख उपलब्धि 1940 के दशक में मिली, जब लिनस पॉलिंग ने इहर्लिश द्वारा प्रस्तावित लॉक-एंड-की सिद्धांत की यह दिखा कर पुष्टि की कि एंटीबॉडी और एंटीजन की आपसी प्रक्रियाएं उनकी रासायनिक संरचना की बजाए उनके आकार पर अधिक निर्भर थी। 1948 में, एस्ट्रिड फेगरेओस ने पाया कि प्लाविका कोशिकाओं के रूप में बी कोशिकाएं (B cells) प्रतिपिंड (एंटीबॉडी) उत्पन्न करने के लिए जिम्मेदार थीं।
आगे का काम प्रतिपिंड (एंटीबॉडी) प्रोटीन की संरचनाओं की विशेषताओं पर केंद्रित रहा. इन संरचनात्मक अध्ययनों में एक प्रमुख उपलब्धि 1960 के दशक के शुरु में गेराल्ड एडलमैन और जोसेफ गैली द्वारा प्रतिपिंड (एंटीबॉडी) हल्की श्रृंखलाओं की खोज और यह उनकी यह मान्यता थी कि यह प्रोटीन 1845 में हेनरी बेंस जोन्स द्वारा वर्णित बेंस-जोन्स प्रोटीन के समान था। एडलमैन ने खोज की कि एंटीबॉडी डाइसल्फाइड बंधन से जुडी भारी तथा हल्की श्रृंखलाओं से बने हैं। लगभग इसी समय, रोडनी पोर्टर द्वारा आईजीजी (IgG) के एंटीबॉडी बाइंडिंग (Fab) तथा एंटीबॉडी टेल (एफसी/Fc) क्षेत्रों का वर्णन किया गया। साथ मिल कर, इन वैज्ञानिकों ने आईजीजी (IgG) की संरचना तथा पूरे अमीनो अम्ल क्रम की खोज की, एक ऐसी उपलब्धि जिसके लिए उन्हें संयुक्त रूप से 1972 में शरीर विज्ञान या औषधि का नोबल पुरस्कार मिला. जबकि अधिकांश शुरूआती अध्ययन आईजीएम (IgM) तथा आईजीजी (IgG) पर केन्द्रित थे, 1960 के दशक में दूसरे इम्युनोग्लोबुलिन आइसोटाइप की पहचान की गयी: थॉमस टोमासी ने स्रावी प्रतिपिंड (एंटीबॉडी) आईजीए (IgA) की खोज की तथा डेविड रोवे व जॉन फाहे ने आईजीडी (IgD) की पहचान की, तथा आईजीई (IgE) की पहचान एलर्जी प्रतिक्रियाओं में शामिल प्रतिपिंड (एंटीबॉडी) के एक वर्ग के रूप में किकिशिगे इशीज़ाका व तेरुकी इशीज़ाका द्वारा की गयी। इम्युनोग्लोबुलिन जीन के शारीरिक पुर्नसंयोजन के समय इन प्रतिपिंड (एंटीबॉडी) प्रोटीनों की विशाल विविधता के आधार को पहचानने वाला आनुवांशिक अध्ययन 1976 में सुसुमू तोनेगावा द्वारा किया गया था।
इन्हें भी देखें
- प्रतिपिंड (एंटीबॉडी) मिथ्या
- विरोधी माईटोकोंड्रिया प्रतिपिंड (एंटीबॉडी)
- विरोधी-परमाणु प्रतिपिंड (एंटीबॉडी)
- कोलोस्ट्रम
- एलीसा
- देहद्रवी रोगक्षमता
- प्रतिरक्षा विज्ञान
- प्रतिरक्षादमन
- शिराभ्यंतर इम्युनोग्लोबुलिन (IVIg)
- चुंबकीय प्रतिरक्षा विश्लेषण
- मोनोक्लोनल प्रतिपिंड (एंटीबॉडी)
- निष्क्रियकारक प्रतिपिंड (एंटीबॉडी)
- गौण प्रतिपिंड (एंटीबॉडी)
- एकल प्रभाव-क्षेत्र प्रतिपिंड (एंटीबॉडी)
बाहरी कड़ियाँ
- कैम्ब्रिज विश्वविद्यालय में माइक के इम्युनोग्लोबुलिन संरचना / कार्य पृष्ठ
- महीने के पीडीबी (PDB) अणु के रूप में प्रतिपिंड (एंटीबॉडी) प्रोटीन डाटा बैंक में प्रतिपिंड (एंटीबॉडी) की संरचना पर चर्चा
- दक्षिण कैरोलिना विश्वविद्यालय में सूक्ष्मजैविकी और प्रतिरक्षा विज्ञान ऑन-लाइन पाठ्यपुस्तक
- ऑक्सफोर्ड विश्वविद्यालय में प्रतिपिंड (एंटीबॉडी) चिकित्सा के एक सौ वर्ष के इतिहास और रोग की चिकित्सा में प्रतिपिंड (एंटीबॉडी) के उपयोग
- सेल्ज़ अलैव से प्रतिपिंड (एंटीबॉडी) का उत्पादन लिम्फ़ोसाइट द्वारा कैसे होता है
- प्रतिपिंड (एंटीबॉडी) अनुप्रयोगों प्रतिदीप्त प्रतिपिंड (एंटीबॉडी) छवि पुस्तकालय, बर्मिंघम विश्वविद्यालय
| Serum |
|
||||||||
|---|---|---|---|---|---|---|---|---|---|
| Other | |||||||||
साँचा:Immune proteins साँचा:स्वप्रतिपिंड