हाइड्रोजन पेरॉक्साइड
| उदजन परूजारक | |
|---|---|
| आईयूपीएसी नाम | dihydrogen dioxide |
| अन्य नाम | Dioxidane |
| पहचान आइडेन्टिफायर्स | |
| सी.ए.एस संख्या | [7722-84-1][CAS] |
| पबकैम | 784 |
| EC संख्या | 231-765-0 |
| UN संख्या | 2015 (>60% soln.) 2014 (20–60% soln.) 2984 (8–20% soln.) |
| RTECS number | MX0900000 (>90% soln.) MX0887000 (>30% soln.) |
| कैमस्पाइडर आई.डी | 763 |
| गुण | |
| आण्विक सूत्र | H2O2 |
| मोलर द्रव्यमान | 34.0147 g/mol |
| दिखावट | Very light blue color; colorless in solution |
| घनत्व | 1.463 g/cm3 |
| गलनांक |
-0.43 °C, 273 K, 31 °F |
| क्वथनांक |
150.2 °C, 423 K, 302 °F |
| जल में घुलनशीलता | Miscible |
| घुलनशीलता | soluble in ether |
| अम्लता (pKa) | 11.62 |
| रिफ्रेक्टिव इंडेक्स (nD) | 1.34 |
| श्यानता | 1.245 cP (20 °C) |
| Dipole moment | 2.26 D |
| Thermochemistry | |
|
फॉर्मेशन की मानक एन्थाल्पीΔfH |
-4.007 kJ/g |
| खतरा | |
| एम.एस.डी.एस | ICSC 0164 (>60% soln.) |
| EU वर्गीकरण | Oxidant (O) Corrosive (C) Harmful (Xn) |
| EU सूचकांक | 008-003-0-9 |
| NFPA 704 | |
| R-फ्रेसेज़ | R5, साँचा:R8, साँचा:R20/22, R35 |
| S-फ्रेसेज़ | (S1/2), साँचा:S17, S26, साँचा:S28, साँचा:S36/37/39, S45 |
| स्फुरांक (फ्लैश पॉइन्ट) | Non-flammable |
| एलडी५० | 1518 mg/kg |
| Related compounds | |
| संबंधित रसायन/मिश्रण |
Water Ozone Hydrazine Hydrogen disulfide |
|
जहां दिया है वहां के अलावा, ये आंकड़े पदार्थ की मानक स्थिति (२५ °से, १०० कि.पा के अनुसार हैं। ज्ञानसन्दूक के संदर्भ | |
'हाइड्रोजन परॉक्साइड (H2O2) एक बहुत हल्का नीला, पानी से जरा सा अधिक गाढ़ा द्रव है जो पतले घोल में रंगहीन दिखता है। इसमें आक्सीकरण के प्रबल गुण होते हैं और यह एक शक्तिशाली विरंजक है। इसका इस्तेमाल एक विसंक्रामक, रोगाणुरोधक, आक्सीकारक और रॉकेट्री में प्रणोदक के रूप में किया जाता है। हाइड्रोजन परॉक्साइड की आक्सीकरण क्षमता इतनी प्रबल होती है कि इसे आक्सीजन की उच्च प्रतिक्रिया वाली जाति समझा जाता है।
हाइड्रोजन परॉक्साइड जीवों में आक्सीकरण चयापचय के उपोत्पाद के रूप में प्राकृतिक रूप से उत्पन्न होता है। लगभग सभी जीवित वस्तुओं (विशेषकर, सभी आब्लिगेटिव और फेकल्टेटिव वातापेक्षी जीव) में परॉक्सिडेज नामक एन्ज़ाइम होते हैं जो बिना हानि पहुंचाए और उत्प्रेरण द्वारा उदजन परूजारक की छोटी मात्राओं को पानी और आक्सीजन में विघटित करते हैं।
अनुक्रम
संरचना और गुण
सभी अणुओं की तरह हाइड्रोजन परॉक्साइड के भौतिक गुण उसके आण्विक परिमाण, रचना और अणु के भीतर परमाणुओं के वितरण का परिणाम होते हैं।
- आण्विक संरचना
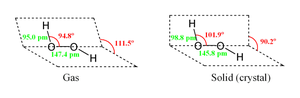
किसी भी अणु की मुख्य रचना वह संरचना होती है जिसमें न्यूनतम आंतरिक तनाव हो। हाइड्रोजन परॉक्साइड के अणु के लिये दो मूल रचनात्मक रूप (कॉनफॉर्मर) उपलब्ध हैं। जहां एंटी कॉनफॉर्मर का सपाट आकार स्टेरिक प्रतिघातों को कम करता है, वहीं सिन कॉनफॉर्मर का 90 डिग्री का टॉर्शन कोण आक्सीजन के भरे हुए पी-टाइप आरबिटल (अकेली जोड़ियों में से एक) और विसिनल O-H बाँड के LUMO के बीच मिश्रण का अनुकूलन करता है।
परिणामी अपनत "तिरछा" आकार दोनो कॉनफॉर्मरों के बीच एक समझौता है।
इस तथ्य के बावजूद कि O-O बाँड एक एकल बाँड है, इस अणु में 29.45 kJ/mol के पूर्ण घूर्णन के प्रति भारी प्रतिरोध होता है (ईथेन के 12.5 kJ/mol वाले घूर्णक प्रतिरोध की तुलना में). इस बढ़े हुए प्रतिरोध का कारण एक एकल जोड़ी और अन्य एकल जोड़ियों के बीच प्रतिघात को माना गया है। बाँड एंगल हाइड्रोजन बाँडिंग से प्रभावित होते हैं जिसका संबंध गैसीय और क्रिस्टलाइन प्रकारों में रचनात्मक अंतर से होता है; सचमुच में आण्विक H2O2 युक्त क्रिस्टलों में काफी बड़ी रेंज पाई जाती है।
- अनुरूपकों से तुलना
हाइड्रोजन परॉक्साइड के अनुरूपकों में रसायनिक रूप से समान दिखने वाले ड्यूटीरियम परॉक्साइड और बदबूदार हाइड्रोजन डाईसल्फाइड शामिल हैं। उच्च अणु भार होने पर भी हाइड्रोजन डाईसल्फाइड का क्वथनांक केवल 70.7 °C ही होता है जिससे संकेत मिलता है कि हाइड्रोजन बाँडिंग हाइड्रोजन परॉक्साइड के क्वथनांक को बढ़ाती है।
- हाइड्रोजन परॉक्साइड घोलों के भौतिक गुण
जलीय हाइड्रोजन परॉक्साइड के बीच हाइड्रोजन बाँडिंग होने के कारण जलयुक्त हाइड्रोजन परॉक्साइड के घोलों के कुछ विशिष्ट गुण होते हैं जो शुद्ध रसायन से भिन्न होते हैं। विशेषकर, हाइड्रोजन परॉक्साइड और पानी मिलकर एक गलनक्रांतिक मिश्रण का निर्माण करते हैं जो हिमांक दबाव दर्शाता है। जबकि शुद्ध जल लगभग 273K पर पिघलता और जमता है और शुद्ध हाइड्रोजन परॉक्साइड उससे सिर्फ 0.4K कम पर पिघलता और जमता है, एक 50% (आयतनानुसार) घोल 221 K पर पिघलता और जमता है।
इतिहास
हाइड्रोजन परॉक्साइड सबसे पहले 1818 में लुई जेकस थेनार्ड द्वारा बेरियम परॉक्साइड पर नाइट्रिक एसिड की प्रक्रिया द्वारा प्राप्त किया गया। इस प्रक्रिया के एक सुधारे हुए प्रकार में हाइड्रोक्लोरिक एसिड और उसके बाद सल्फ्यूरिक एसिड का प्रयोग कर के बेरियम सल्फेट उपोत्पाद को अलग किया जाता है। थेनार्ड की प्रक्रिया 19वीं सदी के अंत से 20वीं सदी के मध्य तक उपयोग में लाई गई। आधुनिक उत्पादन विधियां नीचे दी गई हैं।
लंबे समय तक शुद्ध हाइड्रोजन परॉक्साइड को अस्थिर समझा जाता था क्योंकि हाइड्रोजन परॉक्साइड को पानी, जो संश्लेषण के समय उपस्थित रहता है, से अलग करने के प्रयत्न असफल हो रहे थे। ऐसा इसलिये होता था क्योंकि ठोस पदार्थों और भारी धातु आयनों के अंशों के कारण हाइड्रोजन परॉक्साइड का उत्प्रेरकीय विघटन या विस्फोट हो जाता था। सौ प्रतिशत शुद्ध हाइड्रोजन परॉक्साइड सर्वप्रथम रिचर्ड वोल्फेन्स्टीन ने 1894 में निर्वात आसवन के द्वारा प्राप्त की। पेत्रे मेलिकिश्विली और उसके शिष्य एल.पिज़ारजेवेस्की ने दर्शाया कि हाइड्रोजन परॉक्साइड के अनेक फार्मूलों में से H-O-O-H सबसे सही था।
जीववैज्ञानिक सुरक्षा कैबिनेटों और बैरियर आइसोलेटरों में H2O2 विसंक्रमण का प्रयोग एक सुरक्षित, अधिक प्रभावशाली विसंक्रमण विधि के रूप में इथाइलिन आक्साइड (EtO) का एक लोकप्रिय विकल्प है। दवा उद्योग में H2O2 का प्रयोग काफी समय से बड़े पैमाने पर होता आया है। एयरोस्पेस शोध में H2O2 का प्रयोग उपग्रहों के विसंक्रमण के लिये किया जाता है।
FDA ने कुछ समय पहले व्यक्तिगत मेडिकल उपकरण निर्माण में H2O2 के प्रयोग के लिये 510(k) अनुमति दी है। ANSI/AAMI/ISO 14937 में दिये गए EtO मापदंडों को सत्यापन के दिशा निर्देशों के रूप में उपयोग में लाया जा सकता है। सैन्यो (Sanyo) पहला उत्पादक था जिसने एक सेल क्ल्चर इनकुबेटर में H2O2 प्रक्रिया का प्रयोग किया जो एक तेज और प्रभावशाली सेल कल्चर विसंक्रमण प्रक्रिया है।
उत्पादन
पूर्व में अकार्बनिक विधियों का प्रयोग किया जाता था जिसमें सल्फ्यूरिक एसिड या अम्लीय अमोनियम बाईसल्फेट (NH4HSO4) के जलीय घोल का विद्युतअपघटन किया जाता था जिससे प्राप्त परॉक्सोडाईसल्फेट ((SO4)2)2− का जलअपघटन किया जाता था।
आजकल हाइड्रोजन परॉक्साइड का उत्पादन लगभग अनन्य रूप से एक 2-अल्काइलएंथ्रोक्विनोन (या 2-अल्काइल-9,10-डाईहाइड्रॉक्सीएन्थ्रासीन) का उससे संबंधित दूसरे 2-अल्काइलएंथ्रोक्विनोन से स्वआक्सीकरण करके किया जाता है। बड़े उत्पादक सामान्यतः 2-इथाइल या 2-अमाइल यौगिक का प्रयोग करते हैं। नीचे दर्शाई गई चक्रिक प्रतिक्रिया 2-इथाइल यौगिक दिखा रही है जहां 2-इथाइल-9,10 डाईहाइड्रॉक्सीएन्थ्रासीन (C16H14O2) का उससे संबद्ध 2-इथाइलएन्थ्राक्विनोन (C16H12O2) और हाइड्रोजन परॉक्साइड में आक्सीकरण किया जाता है। अधिकांश व्यावसायिक विधियों में ऐसा एन्थ्रासीन के घोल में से संपीड़ित हवा को बुलबुलों के रूप में प्रवाहित करके किया जाता है, जिससे हवा में मौजूद आक्सीजन अस्थिर (हाइड्रॉक्सी समूह के) हाइड्रोजन परमाणुओं से प्रतिक्रिया करती है, जिसके फलस्वरूप हाइड्रोजन परॉक्साइड निकलती है और एन्थ्राक्विनोन का पुनर्जनन होता है। हाइड्रोजन परॉक्साइड को तब अलग कर लिया जाता है और एन्थ्राक्विनोन को पुनः एक धातु उत्प्रेरक की उपस्थिति में हाइड्रोजन गैस द्वारा डाईहाइड्रॉक्सी (एन्थ्रासीन) यौगिक में बदल दिया जाता है। यही चक्र फिर दोहराया जाता है।
इस विधि को रीडल-फ्लेडरर प्रक्रिया के नाम से जाना जाता है क्योंकि उन्होने 1936 में इस विधि का सर्वप्रथम आविष्कार किया था। इस प्रक्रिया का समीकरण भ्रामक रूप से आसान है:
- H2 + O2 → H2O2
इस प्रक्रिया की अर्थनीति क्विनोन (जो काफी महंगा होता है) और निष्कर्षक विलायकों व हाइड्रोजनक उत्प्रेरक के प्रभावी पुनरोपयोग पर निर्भर है।
1994 में सारे विश्व में H2O2 का उत्पादन करीब 1.9 मिलियन टन था और 2006 में बढ़ कर 2.2 मिलियन टन हो गया जिसमें अधिकांश 70% या कम सांद्रता का होता है।[कृपया उद्धरण जोड़ें] उस वर्ष थोक 30% H2O2 करीब 0.54 अमरीकी डालर प्रति कि.ग्रा. की दर से वेचा गया जो "100% आधार पर[कृपया उद्धरण जोड़ें]" 1.50 डालर प्रति कि.ग्रा. (0.68 डालर प्रति पौंड) के बराबर होता है।
नए घटनाक्रम
एक नई 2-अमाइल एन्थ्राक्विनोन के आइसोमरों के अनुकूलित वितरण पर आधारित तथाकथित "उच्च-उत्पादकता/उच्च-उपज" प्रक्रिया सॉल्वे द्वारा विकसित की गई है। जुलाई 2008 में ज़ैंडविलियेट (बेल्जियम) में इस प्रक्रिया के आधार पर एक विशाल पैमाने का सिंगल-ट्रेन कारखाना निर्मित किया गया। इस कारखाने की क्षमता विश्व के अगले सबसे बड़े सिंगल-ट्रेन कारखाने से दुगुनी से भी अधिक है। एक इससे भी बड़ा संयंत्र 2011 में मैप ता फुट (थाईलैंड) में शुरू होने वाला है। इससे अंदाजा लगाया जा सकता है कि पैमाने की अर्थनीति के कारण उत्पादन के खर्च में कमी होती है।
तत्वों से सीधे हाइड्रोजन परॉक्साइड बनाने की विधि में उत्पादकों की रूचि कई सालों से रही है। सीधे संश्लेषण की विधि की समस्या यह है कि ऊष्मप्रवैगिकी के अनुसार हाइड्रोजन की आक्सीजन से प्रक्रिया से पानी बनता है। कुछ समय से यह जाना गया है कि महीनता से फैलाया गया उत्प्रेरक हाइड्रोजन परॉक्साइड के लिये चयनात्मकता बढ़ाने में लाभदायक हो सकता है। लेकिन जब चयनात्मकता बढ़ाई गई तो भी वह इस प्रक्रिया के व्वावसायिक विकास के लिये अपर्याप्त थी। फिर भी 2000 की शुरूआत में हेडवाटर्स टेक्नालाजी (Headwaters Technology) के शोधकों को कुछ सफलता मिली। यह सफलता कार्बन पर महीन (नैनोमीटर के आकार के) धातु क्रिस्टल कणों के विकास पर निर्भर है। इसके बाद इवोनिक इंडस्ट्रीज़ (Evonik Industries) के साथ संयुक्त उपक्रम में जर्मनी में 2005 के अंत में एक पाइलट संयंत्र का निर्माण किया गया। इस संयंत्र में इस विधि की व्वावसायिक साध्यता के प्रयास चल रहे हैं। यह दावा किया गया है कि निवेश के खर्च में कमी आई है क्योंकि यह विधि सरल है और इसमें कम उपकरणों की जरूरत पड़ेगी लेकिन इस विधि में जंग अधिक लगती है और यह अभी असत्यापित है। इस विधि से उत्पन्न हाइड्रोजन परॉक्साइड कम सांद्रता वाली होती है (एन्थ्राक्विओन विधि में करीब 40 wt% के मुकाबले करीब 5-10 wt%).
2009 में कार्डिफ युनिवर्सिटी के शोधकों ने एक और उत्प्रेरक के विकास की घोषणा की। यह विकास भी सीधे संश्लेषण से संबंध रखता है लेकिन इसमें स्वर्ण-पैलेडियम नैनो कणों का प्रयोग किया गया है। सामान्य परिस्थितियों में हाइड्रोजन परॉक्साइड के बनने के तुरंत बाद उसके विघटन को रोकने के लिये सीधा संश्लेषण अम्लीय माध्यम में किया जाता है। चूंकि हाइड्रोजन परॉक्साइड स्वतः ही विघटित हो जाती है (इसी वजह से उत्पादन के बाद भी ट्रांसपोर्ट के समय या लंबे समय तक रखने के लिये व्वावसायिक उत्पाद में स्थिर कारक मिलाना पड़ता है), उत्प्रेरक की प्रकृति के कारण यह तेजी से विघटित हो सकता है। यह दावा किया गया है कि इस स्वर्ण-पैलेडियम उत्प्रेरक का प्रयोग इस विघटन को कम करता है और इसलिये अम्ल की जरूरत थोड़ी सी या बिलकुल नहीं पड़ती है। यह विधि अभी विकास के बहुत शुरूआती चरण में है और इससे अभी हाइड्रोजन परॉक्साइड की बहुत कम सांद्रताएं बन रही हैं (करीब 1–2 wt% से कम). फिर भी अन्वेषकों का दावा है कि इससे किसी सस्ती, असरदार और पर्यावरण के अनुकूल प्रक्रिया का विकास हो सकेगा।
डो द्वारा क्षारीय हाइड्रोजन परॉक्साइड का उत्पादन करने के लिये एक नई विद्युतरसायनिक विधि का विकास किया गया है। इस विधि में पतले सोडियम हाइड्रॉक्साइड घोल में मोनोपोलार सेल का प्रयोग करके आक्सीजन का विद्युत अपघटन किया जाता है।
उपलब्धता
हाइड्रोजन परॉक्साइड सामान्यतः पानी में घोल के रूप में उपलब्ध है। यह दवा की दुकानों में 3 और 6 wt% सांद्रताओं में मिलता है। सांद्रता का विवरण कभी कभी उत्पन्न की गई आक्सीजन के आयतन (देखिये विघटन) के अनुसार किया जाता है, 20-आयतन के घोल का एक मिलीलीटर पूरी तरह से विघटित होने पर 20 मिलीलीटर आक्सीजन गैस उत्पन्न करता है। प्रयोगशाला में उपयोग के लिये 30 wt% के घोल सामान्य हैं। 70% से 98% के व्यावसायिक ग्रेड भी उपलब्ध हैं लेकिन हाइड्रोजन परॉक्साइड के 68% से अधिक के घोलों के पूर्ण रूप से भाप और आक्सीजन में बदल जाने की आशंका के कारण (सांद्रता के 68% से अधिक होने के साथ भाप का तापमान भी बढता है), ये ग्रेड अधिक खतरनाक समझे जाते हैं और इन्हें रखने के स्थान पर अधिक सावधानी की जरूरत होती है। खरीददार को व्यावसायिक उत्पादकों द्वारा निरीक्षण के लिये तैयार रहना होता है।
प्रतिक्रियाएं
विघटन
हाइड्रोजन परॉक्साइड एक्जोथर्मिक तरीके से स्वतः पानी और आक्सीजन गैस में विघटित होती हैः
- 2 H2O2 → 2 H2O + O2
यह प्रक्रिया ऊष्मप्रवैगिक तौर से सही होती है। इसमें −98.2 kJ·mol−1 का एक ΔH o और −119.2 kJ·mol−1 का एक ΔG o और 70.5 J·mol−1·K−1 का एक ΔS होता है। विघटन की दर परॉक्साइड के तापमान और सांद्रता तथा pH व अशुद्धियों और स्थिरकारकों की उपस्थिति पर निर्भर होती है। हाइड्रोजन परॉक्साइड विघटन में शामिल अधिकांश ट्रांजीशन धातुओं और उनके यौगिकों सहित कई पदार्थों से असंगत होती है। सामान्य उत्प्रेरकों में मैंगनीज डाई आक्साइड और चांदी शामिल हैं। यही प्रक्रिया लिवर में पाए जाने वाले कैटालेज़ एन्ज़ाइम द्वारा उत्प्रेरित की जाती है, जिसका शरीर में मुख्य काम चयापचय के विषाक्त उपोत्पादों को निकालना और आक्सीकरण के तनाव को कम करना है। क्षार में विघटन तेजी से होता है इसलिये अक्सर अम्ल को स्थिरताकारक के रूप में मिलाया जाता है।
विघटन के समय आक्सीजन और ऊर्जा के निकलने के खतरनाक दुष्प्रभाव होते हैं। उच्च सांद्रता के हाइड्रोजन परॉक्साइड के ज्वलनशील पदार्थ पर गिर जाने से तुरंत आग लग सकती है जो विघटित होते हाइड्रोजन परॉक्साइड से निकलती आक्सीजन से और भड़क सकती है। हाई टेस्ट परॉक्साइड या HTP (इसे उच्च ताकत का परॉक्साइड भी कहा जाता है) को किसी अच्छे,[कृपया उद्धरण जोड़ें] हवादार पात्र में रखना चाहिये जिससे आक्सीजन गैस को जमा होने से रोका जा सके, जो अन्यथा अंततः पात्र के फूटने के लिये जिम्मेदार हो सकती है।
कतिपय उत्प्रेरकों, जैसे, Fe2+ या Ti3+, की उपस्थिति में विघटन दूसरे मार्ग से हो सकता है जिसमें मुक्त मूल जैसे HO· (हाइड्रॉक्सिल) और HOO· उत्पन्न होते हैं। H2O2 और Fe2+ के संयोग को फेंटॉन्स रीएजेंट के नाम से जाना जाता है।
हाइड्रोजन परॉक्साइड की एक सामान्य सांद्रता 20-आयतन होती है जिसका मतलब है, जब हाइड्रोजन परॉक्साइड का एक आयतन विघटित होता है तो 20 आयतन आक्सीजन उत्पंन्न होती है। हाइड्रोजन परॉक्साइड का 20-आयतन 1.667 mol/dm3 (मोलार घोल) या करीब 6% के बराबर होता है।
दवाई की दुकानों में उपलब्ध हाइड्रोजन परॉक्साइड तीन प्रतिशत-घोल होता है। इतनी कम सांद्रता में यह कम स्थिर होता है और तेजी से विघटित हो जाता है। इसे साधारणतः एसिटेनिलाइड से स्थिर किया जाता है जो एक ऐसा पदार्थ है जिसके अधिक मात्राओं में भी कम दुष्प्रभाव होते हैं।
रिडॉक्स प्रतिक्रियाएं
H2O2 सबसे शक्तिशाली आक्सीकारकों में से एक है - यह क्लोरीन, क्लोरीन डाईआक्साइड और पोटाशियम परमैंगनेट से भी अधिक शक्तिशाली है। इसके अलावा उत्प्रेरक क्रिया द्वारा H2O2 को हाइड्रॉक्सी मूलों (.OH) में परिवर्तित किया जा सकता है जो प्रतिक्रियात्मकता में फ्लोरीन के बाद दूसरे स्थान पर आता है।
| आक्सीकारक | आक्सीकरण की क्षमता, V |
|---|---|
| फ्लुओरिन | 3.0 |
| हाइड्रॉक्सिल रैडिकल | 2.8 |
| ओज़ोन | 2.1 |
| हाइड्रोजन परॉक्साइड | 1.8 |
| पोटेशियम परमैंगनेट | 1.7 |
| क्लोरीन डाईऑक्साइड | 1.5 |
| क्लोरीन | 1.4 |
जलीय घोलों में हाइड्रोजन परॉक्साइड कई तरह के अकार्बनिक आयनों को आक्सीकृत या घया सकता है। जब यह रिड्यूसिंग एजेंट का काम करता है तो आक्सीजन गैस भी उत्पन्न होती है।
अम्लीय घोलों में Fe2+ का आक्सीकरण Fe3+ में होता है (हाइड्रोजन परॉक्साइड आक्सीकारक का काम करता है),
और सल्फाइट (SO32−) का आक्सीकरण सल्फेट (SO42−) में होता है। हालांकि, अम्लीय H2O2 द्वारा पोटेशियम परमैंगनेट को Mn2+ तक कम कर दिया जाता है। क्षारीय दशा में इनमें से कुछ प्रतिक्रियाएं उल्टी हो जाती हैं; उदा. Mn2+ का आक्सीकरण Mn4+ (जैसे कि MnO2) में होता है।
रिड्यूसिंग एजेंट के रूप में हाइड्रोजन परॉक्साइड का एक और उदाहरण है उसकी सोडियम हाइपोक्लोराइट से प्रतिक्रिया जो प्रयोगशाला में आक्सीजन बनाने का एक आसान तरीका है।
- NaOCl + H2O2 → O2 + NaCl + H2O
हाइड्रोजन परॉक्साइड को कार्बनिक रसायनशास्त्र में अक्सर आक्सीकारक के रूप में इस्तेमाल किया जाता है। इसका एक प्रयोग थायोईथरों को सल्फॉक्साइड में आक्सीकरण करना है।[कृपया उद्धरण जोड़ें] उदा., मिथाइल फिनाइल सल्फाइड का मिथाइल फिनाइल सल्फॉक्साइड में आक्सीकरण मेथेनॉल में 99% यील्ड के साथ 18 घंटों में किया गया (या TiCl3 उत्प्रेरक का प्रयोग करके 20 मिनटों में):[कृपया उद्धरण जोड़ें]
- Ph-S-CH3 + H2O2 → Ph-S(O)-CH3 + H2O
क्षारीय हाइड्रोजन परॉक्साइड का प्रयोग एक्रिलिक एसिडों जैसे इलेक्ट्रॉन की कमी वाले अल्कीनों के इपॉक्सीकरण के लिये और हाइड्रोबोरीकरण-आक्सीकरण के दूसरे कदम, अल्काइलबोरेनों के अल्कोहलों में आक्सीकरण के लिये भी, किया जाता है।
परॉक्साइड यौगिकों का निर्माण
हाइड्रोजन परॉक्साइड एक हल्का अम्ल है और यह कई धातुओं के हाइड्रोपरॉक्साइड या परॉक्साइड लवण या यौगिक बना सकता है।
उदा., क्रोमिक एसिड (CrO3) के जलीय घोल या डाइक्रोमेट लवणों के अम्लीय घोलों में मिलाने पर यह एक अस्थिर नीला परॉक्साइड CrO(O2)2 बनाता है। जलीय घोल में यह तेजी से विघटित हो कर आक्सीजन गैस और क्रोमियम लवण देता है।
यह एनॉयनों से प्रतिक्रिया करके परॉक्सोएनॉयन भी उत्पन्न कर सकता है; उदा., बोराक्स से प्रतिक्रिया से सोडियम बोरेट बनता है जो कपड़े धोने के डिटर्जेंटों में विरंजक का काम करता है।
- Na2B4O7 + 4 H2O2 + 2 NaOH → 2 Na2B2O4(OH)4 + H2O
H2O2कॉर्बॉक्सिलिक एसिडों (RCOOH) को परॉक्सी एसिडों (RCOOOH) में बदल देता है जो स्वयं आक्सीकारकों के रूप में प्रयोग में लाए जाते हैं। हाइड्रोजन परॉक्साइड एसिटोन से प्रतिक्रिया करके एसिटोन परॉक्साइड बनाता है और ओज़ोन से क्रिया करके हाइड्रोजन ट्राईआक्साइड बनाता है जिसे ट्राईआक्सिडेन भी कहते हैं। यूरिया से प्रतिक्रिया से कार्बमाइड परॉक्साइड बनता है जो दांतों को सफेद करने के काम आता है। ट्राईफिनाइलफास्फीन आक्साइड के साथ एक अम्ल-क्षार एडक्ट कुछ प्रतिक्रियाओं में H2O2 का एक उपयोगी "वाहक" है।
क्षारता
हाइड्रोजन परॉक्साइड पानी की अपेक्षा कहीं अधिक कमजोर क्षार है, लेकिन फिर भी यह बहुत प्रबल अम्लों के साथ एडक्ट बना सकता है। सुपरएसिड HF/SbF5, [H3O2]+ आयन युक्त अस्थिर यौगिकों का निर्माण करता है।
उपयोग
औद्योगिक उपयोग
विश्व भर के 1994 में हाइड्रोजन परॉक्साइड के उत्पादन का करीब 50% भाग लुगदी और कागज की ब्लीचिंग में इस्तेमाल किया गया। अन्य ब्लीचिंग प्रयोग भी अधिक महत्वपूर्ण होते जा रहे हैं क्योंकि हाइड्रोजन परॉक्साइड को क्लोरीन पर आधारित ब्लीचों की अपेक्षा पर्यावरण के लिये बेहतर विकल्प के रूप में देखा जा रहा है।
हाइड्रोजन परॉक्साइड के अन्य बड़े औद्यौगिक प्रयोगों में सोडियम परकार्बोनेट और सोडियम परबोरेट का उत्पादन शामिल है, जिन्हें लाँड्री डिटर्जेंटों में हल्के विरंजकों के रूप में प्रयोग किया जाता है। यह कुछ कार्बनिक परॉक्साइडों जैसे डाईबेंजाइल परॉक्साइड के उत्पादन में प्रयोग किया जाता है जो पॉलिमरीकरण और अन्य रसायनिक प्रक्रियाओं में काम आता है। हाइड्रोजन परॉक्साइड का प्रयोग इपॉक्साइडों जैसे प्रोपाइलीन आक्साइड के उत्पादन में भी होता है। कॉर्बॉक्सिलिक एसिड से प्रतिक्रिया से संबंधित परॉक्सी एसिड बनता है। परएसिटिक एसिड और मेटा-क्लोरोपरॉक्सीबेंजॉइक एसिड (संक्षिप्त में mCPBA) क्रमशः एसिटिक एसिड और मेटा -क्लोरोबेंजॉइक एसिड से बनते हैं। द्वितीय यौगिक की अक्सर अल्कीनों से प्रतिक्रिया से संबंधित इपॉक्साइड प्राप्त होता है।
PCB उत्पादन क्रिया में हाइड्रोजन परॉक्साइड और सल्फ्यूरिक एसिड का मिश्रण तांबे की सतह को खुरदुरा करने के लिये माइक्रोएच रसायन के रूप में काम में लाया जाता है।
पाउडर किये हुए बहुमूल्य धातु पर आधारित उत्प्रेरक, हाइड्रोजन परॉक्साइड, मेथेनॉल और पानी का मिश्रण एक से दो सेकंड में सुपरहीटेड भाप का उत्पादन कर सकता है जिससे केवल CO2 और उच्च तापमान वाली भाप कई उद्धेश्यों के लिये प्राप्त की जा सकती है।
हाल में औषधिक उत्पादन में हाफ-सूट और ग्लोव-पोर्ट आइसोलेटरों में वैलिडेशन औऱ बायो-डीकंटामिनेशन के लिये वाष्पीकृत हाइड्रोजन परॉक्साइड का प्रयोग बढ़ गया है।
परमाणु प्रेशराइज्ड वाटर रिएक्टरों (PWRs) में हाइड्रोजन परॉक्साइड संयंत्र के शट-डाउन के समय ईंधन पर जमे एक्टीवेटेड जंग उत्पादों के आक्सीकरण और विलयन के लिये किया जाता है। रिएक्टर को अलग करने के पहले जंग उत्पादों को निकाल दिया जाता है।
हाइड्रोजन परॉक्साइड को तेल और गैस खोज उद्योग में भी सूक्ष्म-जीवाष्म विश्लेषण की तैयारी करते समय रॉक मैट्रिक्स के आक्सीकरण में प्रयोग में लाया जाता है।
रसायनिक उपयोग
हाइड्रोजन परॉक्साइड से प्रोपाइलिन आक्साइड बनाने के एर तरीके का विकास किया गया है। यह विधि पर्यावरण के लिये अच्छी समझी जाती है क्योंकि इसका मुख्य उपोत्पाद केवल पानी ही है। यह भी दावा किया गया है कि इस विधि में निवेश और चलाने की लागत काफी कम है। 2008 में इस तरह के दो "HPPO" (हाइड्रोजन परॉक्साइड से प्रोपाइलिन आक्साइड) संयंत्र चालू किये गए: इनमें से एक बेल्जियम में सॉल्वे और डो-BASF का संयुक्त उपक्रम है और दूसरा कोरिया में इवोनिक हेडवाटर्स और एसके केमिकल्स का संयुक्त उपक्रम है। हाइड्रोजन परॉक्साइड के लिये एक कैप्रोलैक्टम प्रयोग का व्यावसायीकरण किया गया है। हाइड्रोजन परॉक्साइड का प्रयोग करके फिनॉल और एपिक्लोरोङाइड्रिन बनाने के उपाय सोचे जा रहे हैं।
जैविक क्रिया
बॉम्बॉर्डियर बीटल की रक्षा के लिये उपलब्ध दो मुख्य रसायनों में से एक हाइड्रोजन परॉक्साइड है, जो शिकारियों को परे रखने के लिये हाइड्रोक्विनोन से प्रतिक्रिया करता है।
नेचर में प्रकाशित एक अध्ययन के अनुसार हाइड्रोजन परॉक्साइड रोगक्षम तंत्र में भूमिका निभाता है। वैज्ञानिकों ने पाया कि ज़ेबरा मछली के ऊतकों में चोट लगने पर हाइड्रोजन परॉक्साइड निकलती है जो श्वेतरक्तकणों को उस स्थान पर जमा होने और जख्म को सुखाने की प्रक्रिया शुरू करने का संकेत करती है। जब हाइड्रोजन परॉक्साइड को उत्पन्न करने वाले जीनों को निरस्त कर दिया गया तो उस स्थान पर श्वेतरक्तकण जमा नहीं हुए. ये प्रयोग मछलियों पर किये गए थे लेकिन चूंकि जीनविज्ञान के अनुसार मछलियां मनुष्यों से मिलती हैं इसलिये मनुष्यों में भी यही प्रक्रिया होने का अनुमान है। नेचर में दिये गए अध्ययन के अनुसार दमे के रोगियों के फेफड़ों में स्वस्थ लोगों की अपेक्षा हाइड्रोजन परॉक्साइड के अधिक उच्च स्तर होते हैं, जिसे दमे के रोगियों के फेफड़ों में श्वेतरक्त कणों के असामान्य स्तरों के आधार पर समझा जा सकता है।
घरेलू उपयोग
- विरल H2O2 (3% से12%) का प्रयोग अमोनियम हाइड्रॉक्साइड में मिलाकर मनुष्यों के बालों को ब्लीच करने के लिये किया जाता है – इससे "परॉक्साइड ब्लाँड" नामक मुहावरा बना है।
- त्वचा से संपर्क में आने पर इसका अवशोषण होता है जिससे स्थानिक त्वचा केशिका अंतःशल्यता होती है जो त्वचा के अस्थायी श्वेतपन के रूप में दिखाई देती है।
- इसे प्रदर्शन के लिये रखी जाने वाली हड्डियों को सफेद करने में काम में लाया जाता है।
- 3% H2O2 को चिकित्सकों द्वारा जख्मों को साफ करने, मृत ऊतकों को निकालने और मौखिक क्षतशोधक के रूप में काम में लाया जाता है। परॉक्साइड जख्म के धीमे (छोटी रक्तनलिकाओं के) रक्तस्राव को भी रोकता है। हालांकि, हाल ही के अध्ययन का सुझाव दिया है कि हाइड्रोजन परॉक्साइड कोशिकाओं बाधा scarless त्वचा उपचार के रूप में इसे नष्ट कर देता नवगठित. सबसे ऊपर-the-काउंटर परॉक्साइड समाधान घूस के लिए उपयुक्त नहीं हैं।
- यदि कुत्ते ने किसी हानिकारक पदार्थ (चूहे का जहर) को निगल लिया हो तो उसे उल्टी कराने के लिये छोटी मात्रा में हाइड्रोजन परॉक्साइड दिया जा सकता है।
- 3% H2O2 कपड़ों और अन्य वस्तुओं पर से खून के ताजे (लाल) धब्बे निकालने में असरकारी है। इसे खून के धब्बों के गर्म पानी से "सेट" हो जाने के पहले कपड़ों पर लगा देना चाहिये। इसके बाद ठंडे पानी और साबुन का इस्तेमाल करके परॉक्साइड से उपचारित खून को निकालना चाहिये।
- संयुक्त राज्य फुड एंड ड्रग एडमिनिस्ट्रेशन (FDA) ने हाइड्रोजन परॉक्साइड को मछली और उसके अंडों पर फफूंदी के नियंत्रण के लिये निम्न नियंत्रक प्राथमिकता औषधि (LRP) के रूप में वर्गीकृत किया है। (एक्टोपैरासाइट देखें.)
- कुछ बागबानी विशेषज्ञ और हाइड्रोपोनिक्स के प्रयोग करने वाले पानी के घोलों में हल्के हाइड्रोजन परॉक्साइड घोल (स्पैनिश पानी) का प्रयोग करने की सलाह देते हैं। इसके स्वतः विघटन से आक्सीजन निकलती है जो पौधे की जड़ के विकास को बढ़ावा देती है और जड़ की सड़न (आक्सीजन की कमी से जड़ की कोशिकाओं की मृत्यु) और कई अन्य कीटों का उपचार में मदद करती है। इन दावों के समर्थन में कई शोध हुए हैं।
- मछली उत्पादकों द्वारा प्रयोगशाला में की गई परीक्षाओं में दर्शाया गया है कि घरेलू हाइड्रोजन परॉक्साइड को छोटी मछलियों को आक्सीजन देने के लिये सुरक्षित रूप से प्रयोग में लाया जा सकता है। हाइड्रोजन परॉक्साइड मैंगनीज डाई आक्साइड जैसे उत्प्रेरकों की उपस्थिति में विघटित होकर आक्सीजन छोड़ती है।
- हाइड्रोजन परॉक्साइड गंदे पानी के संग्रहण और उपचार तंत्रों में सल्फाइड और कार्बनिक बदबू को नियंत्रित करने वाला शक्तिशाली आक्सीकारक है। यह गंदे पानी के तंत्र में तब डाला जाता है जब हाइड्रोजन सल्फाइड निकलने में 30 मिनट से 5 घंटों का समय उपलब्ध हो। हाइड्रोजन परॉक्साइड हाइड्रोजन सल्फाइड को आक्सीकृत करता है और कार्बनिक गंधों का बायो-आक्सीकरण करता है। हाइड्रोजन परॉक्साइड आक्सीजन और पानी में विघटित हो जाता है और घुली हुई आक्सीजन को तंत्र में छोड़ देता है जिससे जैव-रसायनिक आक्सीजन मांग (BOD) कुछ कम हो जाती है।
- बेकिंग सोडा और हाथ धोने के साबुन की थोड़ी सी मात्रा में मिला देने पर हाइड्रोजन परॉक्साइड गंदी बदबू को दूर करने में असरदार होती है।
- हाइड्रोजन परॉक्साइड को फिनाइल आक्जलेट एस्टर और एक उचित डाई के साथ चमकने वाली छड़ों में आक्सीकारक के रूप में प्रयोग में लाया जाता है। यह एस्टर से प्रतिक्रिया करके अस्थिर CO2डाइमर बनाता है जो उत्तेजित अवस्था में डाई को उत्तेजित करता है; डाई एक फोटॉन (प्रकाश) छोड़ती है और स्वतः अपनी सामान्य दशा में लौट जाती है।
प्रणोदक के रूप में उपयोग
- इस विषय पर अधिक जानकारी हेतु, High test peroxide पर जाएँ
उच्च सांद्रता के H2O2 को HTP या हाई टेस्ट परॉक्साइड कहा जाता है। इसका प्रयोग मोनोप्रोपेलेंट (ईंधन में मिलाए बिना) या बाईप्रोपेलेंट रॉकेट के आक्सीकारक भग के रूप में किया जा सकता है। मोनोप्रोपेलेंट के रूप में प्रयोग के समय 70–98+% सांद्रतायुक्त हाइड्रोजन परॉक्साइड के भाप और आक्सीजन में विघटन का लाभ उठाया जाता है। प्रोपेलेंट को एक रियेक्शन कक्ष में पंप किया जाता है, जहां एक उत्प्रेरक, सामान्यतः चांदी या प्लेटीनम विघटन की शुरूआत करता है जिससे 600 °C पर भाप उत्पन्न होती है जो एक नॉज़ल से बाहर निकाल दी जाती है और जोर का धक्का लगता है। H2O2 मोनोप्रोपेलेंट 161 s (1.6 kN·s/kg) का अधिकतम विशिष्ट आवेग (I sp) उत्पन्न करता है जो इसे कम क्षमता वाला मोनोप्रोपेलेंट बनाता है। परॉक्साइड हाइड्राजीन से बहुत कम आवेग उत्पन्न करता है लेकिन यह विषाक्त नहीं होता। बेल रॉकेट बेल्ट में हाइड्रोजन परॉक्साइड मोनोप्रोपेलेंट का प्रयोग किया गया था।
बाईप्रोपेलेंट के रूप में H2O2 का विघटन करके ईंधन को आक्सीकारक के रूप में जलाया जाता है। ईंधन के अनुसार 350 s (3.5 kN·s/kg) जितने उच्च विशिष्ट आवेगों तक की प्राप्ति की जा सकती है। आक्सीकारक के रूप में प्रयोग करने पर परॉक्साइड द्रव आक्सीजन से कम I sp देता है, किंतु यह गहरा, संग्रह करने योग्य और नॉनक्रयोजनिक होता है तथा गैस टर्बाइनों को चलाकर प्रभावशाली बंद चक्र द्वारा उच्च दबाव उत्पन्न करता है। इसे रॉकेट इंजिनों को ठंडा करने के काम में भी लाया जा सकता है। परॉक्साइड का प्रयोग दूसरे महायुद्ध के जर्मन रॉकेटों (उदाहरण Me-163 के लिये आक्सीक्विनोलीन युक्त टी-स्टॉफ) और कम मूल्य के ब्रिटिश ब्लैक नाईट और ब्लैक ऐरो लांचरों में आक्सीकारक के रूप में बड़ी सफलता से किया गया।
1940 और 1950 के दशकों में वाल्टर टर्बाइन में हाइड्रोजन परॉक्साइड का पानी में डूबे रहने के समय पनडुब्बियों में प्रयोग किया गया; इसे काफी शोरपूर्ण पाया गया और इसे डीजल-विद्युत पावर सिस्टमों की अपेक्षा अधिक रख-ऱखाव की जरूरत पड़ती थी। कुछ टॉरपीडों में हाइड्रोजन परॉक्साइड को आक्सीकारक या प्रोपेलेंट के रूप में इस्तेमाल किया गया लेकिन यह खतरनाक था और अधिकांश नौसेनाओं ने इसका प्रयोग बंद कर दिया है। HMS सिडॉन और रूसी पनडुब्बी कुर्स्क के डूबने के लिये हाइड्रोजन परॉक्साइड के लीक हो जाने को जिम्मेदार समझा जाता है। उदा.के लिये जापानी नौसेना ने टॉरपीडो परीक्षाओं के समय देखा कि HTP पाइपवर्क में समकोण के बेंडों में H2O2 के जमाव के कारण पनडुब्बियों और टॉरपीडों में अक्सर विस्फोट हो जाते हैं। एसएएबी अंडरवाटर सिस्टम्स टॉरपीडो 2000 का निर्माण कर रहा है। स्वीडिश नेवी द्वारा प्रयुक्त इस टॉरपीडो में एक पिस्टन इंजिन का प्रयोग होता है जो एक बाईप्रोपेलेंट सिस्टम में HTP का आक्सीकारक और केरोसीन का ईंधन के रूप में इस्तेमाल करता है।
बड़े इंजिनों में मोनोप्रोपेलेंट के रूप में बहुत कम प्रयोग होने पर भी, छोटे हाइड्रोजन परॉक्साइड एटीट्यूड कंट्रोल थ्रस्टर अभी भी कुछ उपग्रहों में काम में लाए जा रहे है। इन्हें आसानी से थ्रॉटल किया जा सकता है और हाइड्राजीन की अपेक्षा बिना तकलीफ के ईंधन भर कर लांच किया जा सकता है। फिर भी स्पेसक्राफ्ट में उच्च विशिष्ट आवेग और कम विघटन दर होने के कारण हाइड्राजीन का अधिक प्रयोग होता है।
औषधिक उपयोग
हाइड्रोजन परॉक्साइड को FDA द्वारा जीवाणुनाशक, आक्सीकारक व अन्य प्रयोगों के लिये आम तोर पर सुरक्षित माना (GRAS) गया है।
हाइड्रोजन परॉक्साइड कई वर्षों से रोगाणुरोधक और जीवाणुनाशक के रूप में प्रयोग में लाया जाता रहा है। हालांकि पिछले कुछ वर्षों में आसानी से काउंटर पर उपलब्घ उत्पादनों की लोकप्रियता के कारण इसका प्रयोग घट गया है, फिर भी यह अभी भी कई अस्पतालों, डाक्टरों और दंतचिकित्सकों द्वारा इस्तेमाल किया जाता है।
- सभी आक्सीकारक रोगाणुरोधकों की तरह हाइड्रोजन परॉक्साइड भी खुले जख्मों में ऊतकों को हल्का नुकसान करता है, लेकिन केशिका के रक्तस्राव (छिले हुए जख्म में से छोटी रक्त नलियों में से धीरे से रक्त बहना) को तेजी से रोकने में यह असरकारी होता है और इसके लिये व जख्म को साफ करने के लिये कभी-कभी काम में लाया जाता है।
- हाइड्रोजन परॉक्साइड का प्रयोग सही मात्रा में बेकिंग सोडा और नमक में मिला कर टूथपेस्ट के रूप में किया जा सकता है।
- हाइड्रोजन परॉक्साइड और बेंजाइल परॉक्साइड को कभी-कभी मुहांसों के इलाज में प्रयोग किया जाता है।
- हाइड्रोजन परॉक्साइड को पशुचिकित्सकों द्वारा वमनकारक के रूप में उपयोग में लाया जाता है।
- वैकल्पिक उपयोग
- अमेरिकन कैंसर सोसायटी के कथनानुसार "इस बात का कोई वैज्ञानिक सबूत नहीं है कि हाइड्रोजन परॉक्साइड कैंसर के लिये सुरक्षित, असरदार या उपयोगी इलाज है" और उसकी कैंसर के रोगियों के लिये सलाह है कि "वे योग्यतापूर्ण डाक्टरों की निगरानी में रहें जो इलाज के सत्यापित तरीके और नए तरीकों के अनुमोदित क्लिनिकल परीक्षाओं का इस्तेमाल करते हैं।"
- एक और विवादास्पद वैकल्पिक मेडिकल विधि करीब 1% सांद्रता के हाइड्रोजन परॉक्साइड को सांस से अंदर लेना है। उच्च सांद्रता के हाइड्रोजन परॉक्साइड के भीतरी प्रयोग से जानलेवा रक्तविकार हो सकते हैं और हाल में इसका उपचार के रूप में प्रयोग कई मौतों से जोड़ा गया है।
- द्रव आक्सीजन (परिशिष्ट) भी देखें
सुरक्षा
नियमों की भिन्नता के बावजूद कम सांद्रताएं जैसे 3%, बड़े पैमाने पर उपलब्ध हैं और मेडिकल प्रयोग के लिये इसकी खरीद कानून-संगत है। उच्च सांद्रताओं को खतरनाक समझा जाता है और उनके साथ एक सामग्री सुरक्षा डेटा शीट (MSDS) रखी जाती है। उच्च सांद्रताओं में हाइड्रोजन परॉक्साइड एक आक्रामक आक्सीकारक है और मनुष्य की त्वचा सहित कई वस्तुओं को जंग लगा सकती है। अपघटन कारक की उपस्थिति में H2O2 की उच्च सांद्रता की हिंसक प्रतिक्रिया होती है।
40% से अधिक सांद्रता वाली हाइड्रोजन परॉक्साइड स्ट्रीमों को पर्यावरण में छोड़ने पर इसे D001 हानिकारक व्यर्थ पदार्थ माना जाना चाहिये क्योंकि यह एक DOT आक्सीकारक है। D001 हानिकारक व्यर्थ पदार्थों के लिये ईपीए रिपोर्टेबल क्वांटिटी (RQ) 100 पाउंड या करीब दस गैलन सांद्र हाइड्रोजन परॉक्साइड है।
हाइड्रोजन परॉक्साइड को शीतल, हवादार स्थान पर और किसी भी ज्वलनशील पदार्थ से दूर रखना चाहिये। इसे अप्रतिक्रियाशील पदार्थों जैसे स्टेनलैस स्टील या कांच से बने पात्र में रखना चाहिये (अन्य पदार्थ जैसे कुछ प्लास्टिक और अल्यूमिनियम धातुसंकर भी उपयुक्त हैं). चूंकि प्रकाश में यह तुरंत विघटित हो जाता है, इसलिये इसे अपारदर्शी पात्र में रखना चाहिये और औषधिक फार्मुलेशन प्रकाश को फिल्टर करने वाले भूरे रंग के शीशों में मिलते हैं।
शुद्ध या पतले रूप में हाइड्रोजन परॉक्साइड अनेक जोखम उत्पन्न कर सकता हैः
- विस्फोटक भाप. लगभग 70% से अधिक सांद्रताओं पर हाइड्रोजन परॉक्साइड भाप उत्पन्न कर सकता है जो सामान्य वातावरणीय दबाव पर 70 °C (158 °F) से अधिक तापमान पर जल सकती है। इससे बचे हुए द्रव में बॉयलिंग लिक्विड एक्सपैंडिंग एक्सप्लोज़न (BLEVE) हो सकता है।[कृपया उद्धरण जोड़ें] इसीलिये सामान्य दबाव पर हाइड्रोजन परॉक्साइड का आसवन अत्यधिक खतरनाक है।
- खतरनाक प्रतिक्रियाएं. हाइड्रोजन परॉक्साइड भाप हाइड्रोकार्बनों जैसे ग्रीज़ों से मिलकर संवेदनशील संपर्क विस्फोटक बना सकती है। अल्कोहलों, कीटोनों, कार्बॉक्सिलिक एसिडों (विशेषकर एसिटिक एसिड), अमाइनों और फास्फोरस के साथ आग लगने से लेकर विस्फोटों तक खतरनाक प्रतिक्रियाएं रिपोर्ट की गई हैं।[कृपया उद्धरण जोड़ें]
- स्वतः जलना. सांद्र हाइड्रोजन परॉक्साइड यदि कपड़ों (या अन्य ज्वलनशील वस्तुओं) पर गिर जाती है, तो पानी का तब तक वाष्पीकरण करती है जब तक कि सांद्रता पर्याप्त ताकत की न हो जाए और वह वस्तु स्वतः जलने लगती है।
- जंग कारक. सांद्र हाइड्रोजन परॉक्साइड (>50%) जंग कारक होता है और घरेलू ताकत वाले घोल भी आंखों, श्लेष्म झिल्लियों और त्वचा में जलन उत्पन्न कर सकते हैं। हाइड्रोजन परॉक्साइड के घोल को निगलना खास तौर पर खतरनाक होता है क्योंकि आमाशय में विघटन होने पर बड़ी मात्रा में गैस निकलती है (3% घोल के आयतन का 10 गुना) जिससे आंतरिक रक्तस्राव होने लगता है। 10% से अधिक को सांस में भीतर लेने से तीव्र फुफ्फुसीय क्षुब्धता हो सकती है।[कृपया उद्धरण जोड़ें]
- विरंजक. कम सांद्रता वाले हाइड्रोजन परॉक्साइड, (3% या कम के) कई प्रकार के वस्त्रों को विरंजित करके उन्हें गुलाबीपन प्रदान करता है। हाइड्रोजन परॉक्साइड युक्त सामान्य उत्पादनों जैसे फैशियल क्लीनर या काँटैक्ट लेंस घोल का इस्तेमाल करते समय सावधानी बरतनी चाहिये क्योंकि वे अन्य वस्तुओं पर गिर सकते है।
- आंतरिक रोग. हाइड्रोजन परॉक्साइड को बड़ी मात्रा में 3% सांद्रता पर मुंह से लेने पर "मुंह (काली, रोमयुक्त जीभ), गले और पेट में जलन और छाले" उत्पन्न हो सकते हैं। साथ ही "पेटदर्द, उल्टियां और दस्त" हो सकते हैं।
- भाप का दबाव. हाइड्रोजन परॉक्साइड का उल्लेखनीय वाष्प दबाव होता है (1.2 kPa at 50 oC) [CRC हैन्डबुक ऑफ़ केमिस्ट्री एण्ड फिज़िक्स, 76th Ed, 1995-1996] और वाष्प के सामने जाना खतरनाक हो सकता है। हाइड्रोजन परॉक्साइड एक प्राथमिक क्षोभक है जो आंखों और श्वसनतंत्र को प्रभावित करता है और इसकी NIOSH जीवन व स्वास्थ्य के लिये तुरंत खतरे की सीमा (IDLH) केवल 75 ppm है। . इमेडियटली डेंजरस टु लाइफ ऑर हेल्थ कंसेन्ट्रेशंस (IDLH) का प्रलेखन: NIOSH [http://www.cdc.gov/NIOSH/National इन्स्टिट्यूट फॉर ऑक्यूपेशनल सेफ्टी एण्ड हेल्थ] संशोधित IDLH मूल्यों (3/1/95 तक) का रासायनिक सूचीबद्धकरण और प्रलेखन. कम पीपीएम सांद्रता में लंबे समय तक रहना खतरनाक होता है और फेफड़ों को स्थायी रूप से क्षति पहुंचा सकता है और OSHA ऑक्यूपेशनल सेफ्टी एण्ड हेल्थ एडमिनिस्ट्रेशन ने 1.0 ppm की परमिसिबल एक्सपोजर सीमा निर्धारित की है जिसकी 8 घंटे के औसत समय भार (29 CFR 1910.1000, टेबल Z-1) के रूप में गणना की जाती है और ACGIH अमेरिकेन कॉन्फरेंस ऑफ़ इंडस्ट्रियल हाइजीयनिस्ट्स (ACGIH) द्वारा हाइड्रोजन परॉक्साइड का एक ज्ञात पशु कैंसरजनक के रूप में वर्गीकरण किया गया है जिसका मनुष्य से संबंध अज्ञात है।[2008 थ्रेसहोल्ड लिमिट वैल्यूज़ फॉर केमिकल सब्सटांसेस एण्ड फिज़िकल एजेंट्स एण्ड बायोलॉजिकल एक्सपोज़र इंडिसेस, ACGIH] अनुप्रयोग में जहां कहीं भी हाइड्रोजन परॉक्साइड की उच्च सांद्रता का प्रयोग किया जाता हो, उचित रक्षात्मक उपकरणों का प्रयोग करना चाहिये और जहां पर भाप बनती हो ऐसे स्थान हवादार होने चाहिये तथा वहां पर भाप को मॉनीटर करने की उचित व्यवस्था होनी चाहिये। निरंतर गैस मॉनीटर कई उत्पादकों द्वारा उपलब्ध हैं। हाइड्रोजन परॉक्साइड के खतरों की अतिरिक्त जानकारी OSHA के ऑक्यूपेशनल सेफ्टी एण्ड हेल्थ गाइडलाइन फॉर हाइड्रोजन परॉक्साइड से और ATSDR, एजेंसी फॉर टॉक्सिक सब्सटांसेस एण्ड डिज़ीज़ रजिस्ट्री से उपलब्ध है।
- त्वचा विकार. विटिलिगो एक अर्जित त्वचा रोग है जिसमें त्वचा के वर्णक का कमी हो जाती है और यह विश्वभर की जनता के लगभग 0.5-1% को प्रभवित करता है। हाल के अध्ययनों से पता चला है कि इस रोग में बाह्यत्वचा और रक्त में H2O2 के स्तर बढ़ जाते हैं।
ऐतिहासिक घटनाएं
- 16 जुलाई 1934 को कम्मेर्सडोर्फ, जर्मनी में हाइड्रोजन परॉक्साइड का प्रयोग करने वाले एक रॉकेट इंजिन में विस्फोट हो गया जिससे तीन लोग मारे गए। इस घटना के फलस्वरूप वर्नर वॉन ब्राउन ने निश्चय किया कि वे उनके द्वारा विकसित किये गए रॉकेटों में हाइड्रोजन परॉक्साइड का प्रयोग आक्सीकारक के रूप में नहीं करेंगे।
- 28 अक्टूबर 1998 को मेंफिस से ओरलेंडो जा रही नॉर्थवेस्ट एयरलाइंस फ्लाइट 957 में हाइड्रोजन परॉक्साइड के छलक जाने से कई लोग जख्मी हो गए और उसके बाद नॉर्थवेस्ट एयरलाइंस फ्लाइट 7 में आग लग गई।
- द्वितीय विश्व युद्ध के समय नाजी कारा शिविरों में डाक्टरों ने मनुष्यों की हत्या करने के लिये हाइड्रोजन परॉक्साइड के इंजेक्शन देकर प्रयोग किये।
- 21 जुलाई 2005 को लंदन में हुए बम धमाकों में न फूटने वाले बमों में प्रयुक्त सामग्री में हाइड्रोजन परॉक्साइड शामिल था।
- रूसी पनडुब्बी K-141 कुर्स्क एक किरोव क्लास युद्धपोत, प्योत्र वेलिकी पर नकली टॉरपीडो छोड़ने की कसरत करने के लिये समुद्र में निकला। 12 अगस्त 2000 को स्थानीय समयानुसार 11:28 (07:28 UTC) पर टॉरपीडो छोड़ने की तैयारी करते समय विस्फोट हो गया। ऐसा माना जाता है कि यह विस्फोट कुर्स्क के हाइड्रोजन परॉक्साइड-ईंधनयुक्त टॉरपीडों के फेल होने और फट जाने के कारण हुआ। ऐसा समझा जाता है कि टॉरपीडो में प्रणोदक के रूप में प्रयुक्त अत्यधिक सांद्र हाइड्रोजन परॉक्साइड का एक प्रकार, HTP, टॉरपीडो के आवरण में लगी जंग में से रिस गया था। ऐसी ही एक घटना 1955 में HMS सिडॉन की हानि के लिये जिम्मेदार है।
इन्हें भी देखें
टिप्पणियां
ग्रंथ सूची
- जे. ड्रैबोविक्ज़ और अन्य, द सिन्थसस ऑफ़ सल्फोन्स, सल्फ़ॉक्साइड एण्ड साइक्लिक सल्फाइड्स में, पृष्ठ 112-116, जी. कैपोज़ी और अन्य, संस्करण, जॉन विले एण्ड सन्स, चिचेस्टर, UK, 1994. ISBN 0-471-93970-6.
- एन.एन. ग्रीनवुड, ए. अर्नशॉ, केमिस्ट्री ऑफ़ द एलिमेंट्स, द्वितीय संस्करण, बटरवर्थ-हीनेमन, ऑक्सफोर्ड, UK, 1997. H2O2 के गुण और रसायन का एक विशाल विवरण.
- जे. मार्च, एडवांस्ड ऑर्गनिक केमिस्ट्री, चतुर्थ संस्करण, पृष्ठ 723, विले, न्यूयॉर्क, 1992.
- डब्ल्यू.टी. हेस, हाइड्रोजन परॉक्साइड, किर्क-ओथ्मर इनसाइक्लोपीडिया ऑफ़ केमिकल टैक्नोलॉजी में, चतुर्थ संस्करण, विले, न्यूयॉर्क, खण्ड 13, 961-995 (1995).
बाहरी कड़ियाँ
- रॉकेट ईंधन के लिए हाइड्रोजन परॉक्साइड आसवन
- सामग्री सुरक्षा डाटा शीट
- ATSDR एजेंसी फॉर टॉक्सिक सब्सटांसेस एण्ड डिज़ीज़ रजिस्ट्री FAQ
- एक मौखिक कुल्ला के रूप में हाइड्रोजन परॉक्साइड के नकारात्मक प्रभाव
- फ़ूड ग्रेड हाइड्रोजन परॉक्साइड इनफ़ॉर्मेशन
- एक्सपेरिमेंटल रॉकेट प्रोपल्शन सोसायटी
- अंतर्राष्ट्रीय रासायनिक सुरक्षा कार्ड 0164
- NIOSH पॉकेट गाइड टु केमिकल हैज़र्ड्स
- IARC मोनोग्राफ "हाइड्रोजन परॉक्साइड"
- जनरल काइनेटिक्स इंक. हाइड्रोजन परॉक्साइड रॉकेट इंजन और गैस जनरेटर
- ऑक्सीजनेशन थेरपी: कैंसर और एड्स के लिए अप्रमाणित उपचार
- मानव शरीर में हाइड्रोजन परॉक्साइड
- हाइड्रोजन परॉक्साइड के कई आम उपयोगों, खासकर घरेलू उपयोगों, की जानकारी
- दन्त विरंजकों में हाइड्रोजन परॉक्साइड यूरोपियन कमीशन SCCP मूल्यांकन के ग्रीनफैक्ट्स द्वारा सारांश