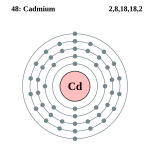
कैडमियम
| कैडमियम / Cadmium रासायनिक तत्व | |
| रासायनिक चिन्ह: | Cd |
| परमाणु संख्या: | 48 |
| रासायनिक शृंखला: | संक्रमण धातु |

आवर्त सारणी में स्थिति
| |
| अन्य भाषाओं में नाम: | Cadmium (अंग्रेज़ी) |
कैडमियम एक रासायनिक तत्व है जिसका प्रतीक Cd है और परमाणु संख्या 48 है। यह नरम, चांदी-सफेद धातु रासायनिक रूप से समूह 12 के दो अन्य स्थिर धातुओं जस्ता और पारा के समान है। जिंक की तरह, यह अपने अधिकांश यौगिकों में ऑक्सीकरण अवस्था +2 को प्रदर्शित करता है, और पारा की तरह, इसका गलनांक 3 से 11 के समूह में संक्रमण धातुओं की तुलना में कम होता है। समूह 12 में कैडमियम और इसके जन्मजात को अक्सर संक्रमण धातु नहीं माना जाता है। कैडमियम के पास मौलिक या सामान्य ऑक्सीकरण अवस्थाओं में आंशिक रूप से भरे हुए d या f इलेक्ट्रॉन शेल नहीं हैं। पृथ्वी की पपड़ी में कैडमियम की औसत सांद्रता 0.1 और 0.5 भाग प्रति मिलियन (पीपीएम) के बीच है। यह 1817 में जर्मनी में स्ट्रोमेयर और हरमन द्वारा एक साथ जस्ता कार्बोनेट में अशुद्धता के रूप में खोजा गया था।
इतिहास
कैडमियम (लैटिन कैडमियम, ग्रीक καδμεία जिसका अर्थ है "कैलामाइन", खनिजों का एक कैडमियम-असर मिश्रण जिसे ग्रीक पौराणिक चरित्र Κάδμος, कैडमस, थेब्स के संस्थापक के नाम पर रखा गया था) की खोज 1817 में जर्मनी में फार्मेसियों में बेचे जाने वाले दूषित जस्ता यौगिकों में फ्रेडरिक स्ट्रोमेयर द्वारा की गई थी। कार्ल सैमुअल लेबेरेच्ट हरमन ने एक साथ जिंक ऑक्साइड में मलिनकिरण की जांच की और हाइड्रोजन सल्फाइड के साथ पीले रंग के अवक्षेप के कारण पहले आर्सेनिक होने का संदेह होने पर एक अशुद्धता पाई। इसके अतिरिक्त स्ट्रोमेयर ने पाया कि एक आपूर्तिकर्ता ने जिंक ऑक्साइड के बजाय जिंक कार्बोनेट बेचा। स्ट्रोमेयर ने नए तत्व को जिंक कार्बोनेट (कैलेमाइन) में अशुद्धता के रूप में पाया, और 100 वर्षों तक, जर्मनी धातु का एकमात्र महत्वपूर्ण उत्पादक बना रहा। धातु का नाम कैलामाइन के लैटिन शब्द के नाम पर रखा गया था, क्योंकि यह इस जस्ता अयस्क में पाया जाता था। स्ट्रोमेयर ने नोट किया कि कैलामाइन के कुछ अशुद्ध नमूने गर्म होने पर रंग बदलते हैं लेकिन शुद्ध कैलामाइन नहीं। वह इन परिणामों का अध्ययन करने में निरंतर थें और अंततः सल्फाइड को भूनकर और कम करके कैडमियम धातु को अलग कर दिया। वर्णक के रूप में कैडमियम पीले रंग की क्षमता को 1840 के दशक में पहचाना गया था, लेकिन कैडमियम की कमी ने इस आवेदन को सीमित कर दिया।
विशेषताएं
भौतिक गुण
कैडमियम एक नरम, लचीला, नमनीय, चांदी-सफेद द्विसंयोजक धातु है। यह कई मायनों में जिंक के समान है लेकिन यह एक जटिल यौगिक बनाता है। अधिकांश अन्य धातुओं के विपरीत, कैडमियम जंग के लिए प्रतिरोधी है और अन्य धातुओं पर एक सुरक्षात्मक प्लेट के रूप में प्रयोग किया जाता है। थोक धातु के रूप में, कैडमियम पानी में अघुलनशील है और ज्वलनशील नहीं है; हालांकि, अपने पाउडर के रूप में यह जल सकता है और जहरीले धुएं को छोड़ सकता है।
रासायनिक गुण
हालांकि कैडमियम में आमतौर पर +2 की ऑक्सीकरण अवस्था होती है, यह +1 अवस्था में भी मौजूद होती है। कैडमियम और इसके जन्मजात को हमेशा संक्रमण धातु नहीं माना जाता है, इसमें मौलिक या सामान्य ऑक्सीकरण अवस्थाओं में आंशिक रूप से भरे हुए डी या एफ इलेक्ट्रॉन के शेल नहीं होते हैं। कैडमियम भूरा अनाकार कैडमियम ऑक्साइड (CdO) बनाने के लिए हवा में जलता है; इस यौगिक का क्रिस्टलीय रूप से गहरे लाल रंग का होता है जो गर्म करने पर जिंक ऑक्साइड के समान रंग बदलता है।
यौगिक
कैडमियम ऑक्साइड का उपयोग काले और सफेद टेलीविजन फॉस्फोर में और रंगीन टेलीविजन कैथोड रे ट्यूब के नीले और हरे रंग के फॉस्फोर में किया गया था। कैडमियम सल्फाइड (सीडीएस) का उपयोग फोटोकॉपियर ड्रम के लिए एक फोटोकॉन्डक्टिव सतह कोटिंग के रूप में किया जाता है, पेंट पिगमेंट में विभिन्न कैडमियम लवणों का उपयोग किया जाता है, जिसमें सीडीएस एक पीले रंग के रंगद्रव्य के रूप में सबसे आम है। कैडमियम सेलेनाइड एक लाल रंगद्रव्य है, जिसे आमतौर पर कैडमियम लाल कहा जाता है। वर्णक के साथ काम करने वाले चित्रकारों के लिए, कैडमियम सबसे शानदार और टिकाऊ पीला, नारंगी और लाल रंग प्रदान करता है। ये रंगद्रव्य संभावित रूप से जहरीले होते हैं, उपयोगकर्ताओं को त्वचा के माध्यम से अवशोषण को रोकने के लिए हाथों पर एक क्रीम का उपयोग करते हैं भले ही त्वचा के माध्यम से शरीर में अवशोषित कैडमियम की मात्रा 1% से कम हो।
बहरी कड़ी
| समूह → | १ | २ | ३ | ४ | ५ | ६ | ७ | ८ | ९ | १० | ११ | १२ | १३ | १४ | १५ | १६ | १७ | १८ | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ आवर्त | ||||||||||||||||||||
| ० | ० / |
|||||||||||||||||||
| १ | १ H |
२ He |
||||||||||||||||||
| २ | ३ Li |
४ Be |
५ B |
६ C |
७ N |
८ O |
९ F |
१० Ne |
||||||||||||
| ३ | ११ Na |
१२ Mg |
१३ Al |
१४ Si |
१५ P |
१६ S |
१७ Cl |
१८ Ar |
||||||||||||
| ४ | १९ K |
२० Ca |
२१ Sc |
२२ Ti |
२३ V |
२४ Cr |
२५ Mn |
२६ Fe |
२७ Co |
२८ Ni |
२९ Cu |
३० Zn |
३१ Ga |
३२ Ge |
३३ As |
३४ Se |
३५ Br |
३६ Kr |
||
| ५ | ३७ Rb |
३८ Sr |
३९ Y |
४० Zr |
४१ Nb |
४२ Mo |
४३ Tc |
४४ Ru |
४५ Rh |
४६ Pd |
४७ Ag |
४८ Cd |
४९ In |
५० Sn |
५१ Sb |
५२ Te |
५३ I |
५४ Xe |
||
| ६ | ५५ Cs |
५६ Ba |
* |
७२ Hf |
७३ Ta |
७४ W |
७५ Re |
७६ Os |
७७ Ir |
७८ Pt |
७९ Au |
८० Hg |
८१ Tl |
८२ Pb |
८३ Bi |
८४ Po |
८५ At |
८६ Rn |
||
| ७ | ८७ Fr |
८८ Ra |
** |
१०४ Rf |
१०५ Db |
१०६ Sg |
१०७ Bh |
१०८ Hs |
१०९ Mt |
११० Ds |
१११ Rg |
११२ Cn |
११३ Nh |
११४ Fl |
११५ Mc |
११६ Lv |
११७ Ts |
११८ Og |
||
| ८ | ११९ Uue |
१२० Ubn |
*** |
|||||||||||||||||
| * लैन्थनाइड | ५७ La |
५८ Ce |
५९ Pr |
६० Nd |
६१ Pm |
६२ Sm |
६३ Eu |
६४ Gd |
६५ Tb |
६६ Dy |
६७ Ho |
६८ Er |
६९ Tm |
७० Yb |
७१ Lu |
|||||
| ** ऐक्टिनाइड | ८९ Ac |
९० Th |
९१ Pa |
९२ U |
९३ Np |
९४ Pu |
९५ Am |
९६ Cm |
९७ Bk |
९८ Cf |
९९ Es |
१०० Fm |
१०१ Md |
१०२ No |
१०३ Lr |
|||||
| *** महालैन्थनाइड | १२१ Ubu |
१२२ Ubb |
१२३ Ubt |
१२४ Ubq |
१२५ Ubp |
१२६ Ubh |
१२७ Ubs |
१२८ Ubo |
१२९ Ube |
१३० Utn |
१३१ Utu |
१३२ Utb |
१३३ Utt |
१३४ Utq |
१३५ Utp |
|||||
आवर्त सारणी के इस प्रचलित प्रबन्ध में लैन्थनाइड और ऐक्टिनाइड को अन्य धातुओं से अलग रखा गया है। विस्तृत और अति-विस्तृत आवर्त सारणीओं में एफ़-खण्ड और जी-खण्ड धातुओं को भी एक साथ प्रबन्धित किया जाता है।
|
आवर्त सारणी में तत्त्वों की श्रेणियाँ
| ||||||||||||||||||||||
|
|
|||||||||||||||||||||